题目内容
【题目】某同学用Na2CO3和NaHCO3溶液进行如图所示实验.下列说法中,正确的是( ) 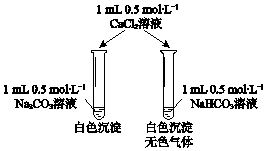
A.实验前两溶液的pH相等
B.实验前两溶液中离子种类完全相同
C.加入CaCl2溶液后生成的沉淀一样多
D.加入CaCl2溶液后反应的离子方程式都是CO32﹣+Ca2+═CaCO3↓
【答案】B
【解析】解:A.等浓度的Na2CO3和NaHCO3溶液中,碳酸钠溶液中碳酸根离子水解程度大于碳酸氢根离子,溶液PH不同.碳酸钠溶液PH大于碳酸氢钠,故A错误;
B.溶液中阴阳离子为碳酸根离子、碳酸氢根离子、氢氧根离子、钠离子和氢离子,实验前两溶液中离子种类完全相同,故B正确;
C.碳酸氢钠和氯化钙溶液不反应,碳酸钠和氯化钙1:1反应生成碳酸钙沉淀,加入CaCl2溶液后生成的沉淀不一样多,故C错误;
D.加入CaCl2溶液后,碳酸钠溶液中反应的离子方程式都是CO32﹣+Ca2+═CaCO3↓,碳酸氢钠和氯化钙不反应,故D错误;
故选B.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目