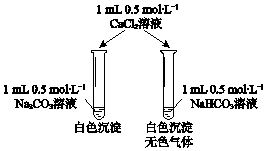
��Ŀ����
����Ŀ��SO2��NO2���γ����꣬ijͬѧ������Ϊ�������������ʵ�飺
��ʵ��һ������ֻ����ƿ�ռ��������������������壬Ȼ���䵹����ˮ���У��ֱ���ͨ������O2��Cl2����ͼA��B��C��ʾ��һ��ʱ���A��Bװ�õļ���ƿ�г�����Һ������ƿ��Һ�岻��ɢ����Cװ�õļ���ƿ�л�������ʣ��(�ɿ���Һ�����ɢ) ��
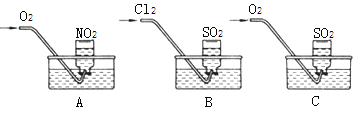
��1��д��װ��A���ܷ�Ӧ�Ļ�ѧ����ʽ________________�������ʵ�������£�����Ħ�����Ϊa L/mol����װ��A�ļ���ƿ��������Һ���ʵ����ʵ���Ũ��Ϊ______��
��2��д��Bװ�õ���Һ��������ƿʱ���йط�Ӧ�����ӷ���ʽ__________________��
��3��ʵ��ǰ��Cװ�õ�ˮ����μӼ�����ɫʯ����Һ��ͨ�������ɹ۲쵽��ʵ����������Һ��ɫ���д����Ӧ���ܻ�ѧ����ʽ___________________________��
��ʵ�����������ͼB��ԭ���������ͼװ�òⶨij���Ṥ���ŷ�β���ж�������ĺ�����ͼ����������������ȷ����ͨ����β���������β��ͨ��һ������ĵ�ˮ����ͨ��ʵ��ⶨSO2�ĺ�������ϴ��ƿD����Һ��ɫ�պ���ʧʱ�������رջ���K��
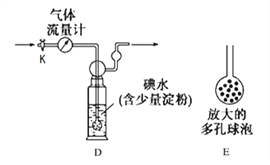
��4��D�е���ĩ������һ���������E����������________���������ʵ���ȷ�ȡ�
��5�����������иպ�ͨ��2Lβ��ʱ��D����Һ��ɫ�պ���ʧ�������رջ���K������D��ǡ�õõ�100mL��Һ��������Һȫ��ת������ƿ�У��������BaCl2��Һ�����ˡ�ϴ�ӡ�����õ�4.66g ��ɫ������ͨ�������֪������β���ж�������ĺ���Ϊ________g/L����ϴ��ƿD����Һ��ɫ��ʧ��û�м�ʱ�رջ���K����õ�SO2����________(�ƫ�ߡ�����ƫ�͡�����Ӱ�족)��
��6������⻯��H2S����ȼ��Ҳ���ܲ�����Ⱦ��SO2���Լ��㣺��״���£�0.35molH2S��11.2LO2�ڵ�ȼ�����³�ַ�Ӧ��������������������Ϊ________g��
���𰸡� 4NO2+O2+2H2O�T4HNO3 1/a mol/L SO2+Cl2+2H2O=4H++SO42��+2Cl�� 2SO2+O2+2H2O=2H2SO4 (2H2SO3+O2=2H2SO4 Ҳ��) ������SO2���ˮ��Ӧ(��ˮ�������) 0.64 ƫ�� 21.6
������������������������֪��AƿNO2��O2���ʵ�������Ͽ�����ȫ����ˮ����HNO3��B�ж�������������ʵ�������Ͽ�����ȫ����ˮ������������C�ж�����������ˮ���������ᣬͨ����������Ѳ�������������Ϊ���ᡣ
��1��װ��A���ܷ�Ӧ�Ļ�ѧ����ʽΪ4NO2+O2+2H2O�T4HNO3�������ʵ�������£�����Ħ�����Ϊa L/mol�����輯��ƿ���ݻ�Ϊ1L������ƿ���ݻ���Ӱ����Һ��Ũ�ȣ�����NO2��HNO3��Һ�������Ϊ1L��n(HNO3)=n(NO2)=![]() ��װ��A�ļ���ƿ��������Һ���ʵ����ʵ���Ũ��Ϊ1/a mol/L��
��װ��A�ļ���ƿ��������Һ���ʵ����ʵ���Ũ��Ϊ1/a mol/L��
��2��װ�õ���Һ��������ƿʱ����Ӧ�����ӷ���ʽSO2+Cl2+2H2O=4H++SO42��+2Cl����
��3��ʵ��ǰ��Cװ�õ�ˮ����μӼ�����ɫʯ����Һ��ͨ�������ɹ۲쵽��ʵ����������Һ��ɫ���˵����Һ��������ǿ����Ӧ���ܻ�ѧ����ʽΪ2SO2+O2+2H2O=2H2SO4 (��2H2SO3+O2=2H2SO4)��
��4��D�е���ĩ������һ���������E������������������������ˮ��Ӧ�ĽӴ������������SO2���ˮ��Ӧ(��ˮ�������)���������ʵ���ȷ�ȡ�
��5�����������иպ�ͨ��2Lβ��ʱ��D����Һ��ɫ�պ���ʧ�������رջ���K������D��ǡ�õõ�100mL��Һ��������Һȫ��ת������ƿ�У��������BaCl2��Һ�����ˡ�ϴ�ӡ�����õ�4.66g ��ɫ�������ó���Ϊ���ᱵ�������ʵ���Ϊ0.02mol����n(SO2)= 0.02mol�����ԣ�����β���ж�������ĺ���Ϊ![]() 0.64 g/L����ϴ��ƿD����Һ��ɫ��ʧ��û�м�ʱ�رջ���K����β�����ƫ��Ȼ���²�õ�SO2����ƫ����
0.64 g/L����ϴ��ƿD����Һ��ɫ��ʧ��û�м�ʱ�رջ���K����β�����ƫ��Ȼ���²�õ�SO2����ƫ����
��6����״���£�0.35molH2S��11.2LO2�ڵ�ȼ�����³�ַ�Ӧ��11.2LO2�����ʵ���Ϊ0.5mol��H2S���ܷ���������Ӧ��2H2S+O2=2S+2H2O ��2H2S+3O2=2SO2+2H2O����ȻO2������������H2S��ȫȼ������Ҫ������H2S������������S������SO2����S�غ�ɵ�n(S)+n(SO2)=n(H2S)= 0.35mol��![]() n(S)+
n(S)+![]() n(SO2)=n(O2)= 0.5mol������ʽ����������ɽ�ã�n(S) =0.025mol ��n(SO2)=0.325mol��������������������Ϊ0.025mol
n(SO2)=n(O2)= 0.5mol������ʽ����������ɽ�ã�n(S) =0.025mol ��n(SO2)=0.325mol��������������������Ϊ0.025mol![]() +0.325mol
+0.325mol ![]() 21.6g��
21.6g��

 �̲�ȫ���ִʾ�ƪϵ�д�
�̲�ȫ���ִʾ�ƪϵ�д�����Ŀ��ij�¶��£���Ӧ 2CH3OH��g�� ![]() CH3OCH3��g��+H2O��g����ƽ�ⳣ��Ϊ400�����¶��£����ݻ�һ�����ܱ������м���CH3OH����Ӧ��ijʱ�̲�ø���ֵ�Ũ�����£�
CH3OCH3��g��+H2O��g����ƽ�ⳣ��Ϊ400�����¶��£����ݻ�һ�����ܱ������м���CH3OH����Ӧ��ijʱ�̲�ø���ֵ�Ũ�����£�
���� | CH3OH | CH3OCH3 | H2O |
Ũ��/��molL��1�� | 0.44 | 0.6 | 0.6 |
����˵����ȷ���ǣ� ��
A.CH3OH����ʼŨ��Ϊ1.04mol/L
B.��ʱ�淴Ӧ���ʴ�������Ӧ����
C.ƽ��ʱCH3OH��Ũ��Ϊ0.04mol/L
D.ƽ��ʱCH3OH��ת����С��80%