题目内容
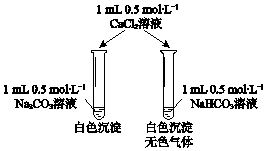
【题目】为了从海带浸取液中提取碘,某同学设计了如下实验方案:( )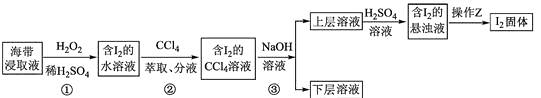
下列说法正确的是
A.①中反应的离子方程式:2I + H2O2 = I2 + 2OH
B.②中分液时含I2的CCl4溶液从分液漏斗上口倒出
C.③中得到的上层溶液中含有I
D.操作Z的名称是加热
【答案】C
【解析】A.①中在酸性溶液中不可能生成OH,故A不符合题意;
B.四氯化碳的密度比水大,②中分液时含I2的CCl4溶液从分液漏斗下口放出,故B不符合题意;
C.碘化钠水溶液的密度比四氯化碳小,③中得到的上层溶液中含有I,故C符合题意;
D.从含有碘的悬浊液中得到碘,应该采用过滤的方法,故D不符合题意。
故答案为:C
A.在有硫酸参加反应时不能生成氢氧根离子;
B.四氯化碳层在下层,应由下口流出;
C.碘与NaOH反应生成含碘化合物;
D.分离固体和液体采用过滤的方法.

 阅读快车系列答案
阅读快车系列答案【题目】为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应的措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.
(1)实验测得,5g甲醇(CH3OH,液态)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式: .
(2)已知化学键的键能为:
化学键 | H﹣H | N﹣H | N≡N |
键能/kJmol﹣1 | 436 | 391 | 945 |
又知反应N2(g)+3H2(g)2NH3(g)△H=a kJmol﹣1 . 试根据表中所列键能数据估算a的值为 .
(3)已知:C(s,石墨)+O2(g)═CO2(g)△H=﹣393kJmol﹣1
2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJmol﹣1
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=﹣2599kJmol﹣1
根据盖斯定律,计算 298K时C(s,石墨)和H2(g)反应生成1mol C2H2(g)的焓变为 .
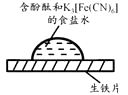
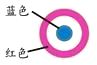
【题目】某同学进行下列实验:( )
操作 | 现象 |
|
|
下列说法不合理的是
A.生铁片发生吸氧腐蚀
B.中心区:Fe–2e-=Fe2+
C.边缘处:O2+2H2O+4e-=4OH-
D.交界处:4Fe2++O2+10H2O=4Fe(OH)3+8H+