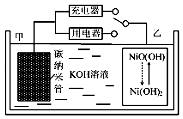
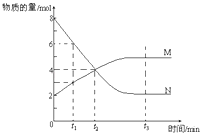
题目内容
【题目】A、B、C、D、E四种短周期元素的原子序数逐渐增大。A为非金属元素,且A、E同主族,C、D为同周期的相邻元素。E原子的质子数等于C、D原子最外层电子数之和。B原子最外层电子数是内层电子数的2倍。C的氢化物分子中有3个共价键,试推断:
(1)写出B元素在周期表中的位置____________________;
(2)由A、C、D所形成的离子化合物是_______________(填化学式),所含化学键类型为_____________,它与E的最高价氧化物对应水化物的溶液加热时反应的离子方程式是___________________________。
(3) C单质的电子式为____________________。
(4) B和D相比,非金属性较强的是_________________(用元素符号表示),下列事实能证明这一结论的是________________(选填字母序号)。
a.常温下,B的单质呈固态,D的单质呈气态 b.D的氢化物的稳定性强于B的氢化物
c.B与D形成的化合物中,B呈正价 d.D的氢化物的沸点高于B的氢化物
【答案】 第二周期第ⅣA 族 NH4NO3 极性键、离子键 NH4++OH-![]() NH3↑+H2O
NH3↑+H2O ![]() O bc
O bc
【解析】 根据元素的位置及结构特点可判断,A、B、C、D、E四种短周期元素H、C、N、O、Na。
(1)碳元素位于周期表的第二周期第ⅣA;(2)A、C、D所形成的离子化合物是NH4NO3,所含化学键类型为极性键、离子键;和氢氧化钠反应生成氨气,方程式为NH4++OH-![]() NH3↑+H2O;(3)氮气分子中含有氮氮三键,电子式为
NH3↑+H2O;(3)氮气分子中含有氮氮三键,电子式为![]() ;(4)同周期自左向右非金属性逐渐减弱,所以氧元素的非金属性大于碳的非金属性。故非金属性较强的是O;比较元素非金属性强弱的依据:①.依据非金属单质与H2反应的难易程度、剧烈程度和生成气态氢化物的稳定性。与氢气反应越容易、越剧烈,气态氢化物越稳定,其非金属性越强;②.依据最高价氧化物的水化物酸性的强弱。酸性越强,其元素的非金属性越强;③.依据元素周期表。同周期中,从左向右,随着核电荷数的增加,非金属性逐渐增强;同主族中,由上而下,随着核电荷数的增加,非金属性逐渐减弱;④.非金属单质与盐溶液中简单阴离子之间的置换反应。非金属性强的置换非金属性弱的;⑤.非金属单质与具有可变价金属的反应。能生成高价金属化合物的,其非金属性强。所以答案选bc。
;(4)同周期自左向右非金属性逐渐减弱,所以氧元素的非金属性大于碳的非金属性。故非金属性较强的是O;比较元素非金属性强弱的依据:①.依据非金属单质与H2反应的难易程度、剧烈程度和生成气态氢化物的稳定性。与氢气反应越容易、越剧烈,气态氢化物越稳定,其非金属性越强;②.依据最高价氧化物的水化物酸性的强弱。酸性越强,其元素的非金属性越强;③.依据元素周期表。同周期中,从左向右,随着核电荷数的增加,非金属性逐渐增强;同主族中,由上而下,随着核电荷数的增加,非金属性逐渐减弱;④.非金属单质与盐溶液中简单阴离子之间的置换反应。非金属性强的置换非金属性弱的;⑤.非金属单质与具有可变价金属的反应。能生成高价金属化合物的,其非金属性强。所以答案选bc。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
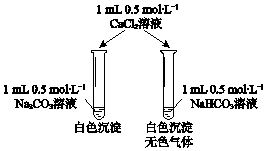
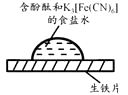
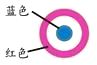
开心蛙口算题卡系列答案【题目】某同学进行下列实验:( )
操作 | 现象 |
|
|
下列说法不合理的是
A.生铁片发生吸氧腐蚀
B.中心区:Fe–2e-=Fe2+
C.边缘处:O2+2H2O+4e-=4OH-
D.交界处:4Fe2++O2+10H2O=4Fe(OH)3+8H+