题目内容
【题目】NO2是大气污染物,但只要合理利用也是重要的资源。回答下列问题:
(1)NO2可以被NaOH溶液捕获生成两种钠盐,溶液呈碱性,写出反应的化学方程式______________,已知常温下,HNO2的电离平衡常数为Ka=5.0×10-4,则0.1mo/L NaNO2中c(OH-)=_____________(已知![]() )
)
(2)2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步,反应情况如下表:
2NO2(g)的反应历程分两步,反应情况如下表:
反应 | 速率表达式 | 反应热 |
反应I:2NO(g) |
| △H1<0 |
反应II:N2O2(g)+O2(g) |
| △H2<0 |
反应2NO(g)+O2(g) ![]() 2NO2(g)的△H______(用△H1、△H2表示)。一定温度下,反应2NO(g)+O2(g)
2NO2(g)的△H______(用△H1、△H2表示)。一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,若升高温度,K将____(填“增大”、“减小”或“不变”),平衡常数的表达式K=____(用
2NO2(g)达到平衡状态,若升高温度,K将____(填“增大”、“减小”或“不变”),平衡常数的表达式K=____(用![]() 、
、![]() 、
、![]() 、
、![]() 表示)
表示)
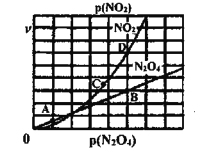
(3)反应N2O4(g) ![]() 2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强关系为:υ(N2O4)=k1· p(N2O4),υ(NO2)=k2· p(NO2),其中
2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强关系为:υ(N2O4)=k1· p(N2O4),υ(NO2)=k2· p(NO2),其中![]() 、
、![]() 是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态对应的两个点是___________
是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态对应的两个点是___________
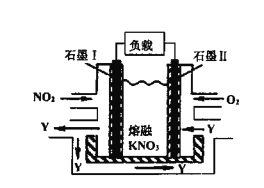
(4)NO2、O2和熔融KNO3可制作燃料电池,其原理如图,该电池在使用过程中石墨I电极上生成氧化物Y,Y可循环使用。Y的化学式为____________
【答案】2NO2+2NaOH=NaNO3+NaNO2+H2O 1.414×10-6mol/L △H1+△H2 减小 k1正k2正/k1逆k2逆 BD N2O5
【解析】
(1)NO2和NaOH溶液反应生成生成两种钠盐,必然是NO2的歧化反应,根据元素守恒可知两种盐为NaNO3、NaNO2,反应的化学方程式为:2NO2+2NaOH=NaNO3+NaNO2+H2O,HNO2为弱酸,0.1mo/LNaNO2中,根据NO2-+H2O![]() OH-+HNO2可知,c(HNO2)c(OH-)/c(NO2-)= c(HNO2)c(OH-)c(H+)/[c(NO2-)c(H+)]=Kw/Ka=c2(OH-)/c(NO2-)=1.0×10-14/(5×10-4)=2×10-11,其中c(NO2-)=0.1mol/L,故c(OH-)=1.414×10-6mol/L,故答案为:2NO2+2NaOH=NaNO3+NaNO2+H2O ;1.414×10-6mol/L。
OH-+HNO2可知,c(HNO2)c(OH-)/c(NO2-)= c(HNO2)c(OH-)c(H+)/[c(NO2-)c(H+)]=Kw/Ka=c2(OH-)/c(NO2-)=1.0×10-14/(5×10-4)=2×10-11,其中c(NO2-)=0.1mol/L,故c(OH-)=1.414×10-6mol/L,故答案为:2NO2+2NaOH=NaNO3+NaNO2+H2O ;1.414×10-6mol/L。
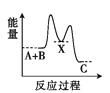
(2)①2NO(g)![]() N2O2(g);②N2O2(g)+O2(g)
N2O2(g);②N2O2(g)+O2(g)![]() 2NO2(g),而目标反应2NO(g)+O2(g)
2NO2(g),而目标反应2NO(g)+O2(g)![]() 2NO2(g)的△H=①+②=△H1+△H2;由于△H1、△H2均<0,则反应2NO(g)+O2(g)
2NO2(g)的△H=①+②=△H1+△H2;由于△H1、△H2均<0,则反应2NO(g)+O2(g)![]() 2NO2(g)为放热反应,所以升高温度,平衡逆向移动,平衡常数减小;反应达平衡状态时,υ1正=υ1逆、υ2正=υ2逆,所以υ1正×υ2正=υ1逆×υ2逆,即k1正c2(NO)×k2正c(N2O2)c(O2)=k1逆c(N2O2)×k2逆c2(NO2),则是K=c2(NO2)/[c(N2O2)c(O2)]=k1正k2正/k1逆k2逆;
2NO2(g)为放热反应,所以升高温度,平衡逆向移动,平衡常数减小;反应达平衡状态时,υ1正=υ1逆、υ2正=υ2逆,所以υ1正×υ2正=υ1逆×υ2逆,即k1正c2(NO)×k2正c(N2O2)c(O2)=k1逆c(N2O2)×k2逆c2(NO2),则是K=c2(NO2)/[c(N2O2)c(O2)]=k1正k2正/k1逆k2逆;
故答案为:△H1+△H2;减小;k1正k2正/k1逆k2逆。
(3)反应N2O4(g)![]() 2NO2(g)达到平衡时N2O4、NO2的消耗速率之比应为1:2,根据图像,能表示反应达到平衡状态的对应的两个点是B和D,
2NO2(g)达到平衡时N2O4、NO2的消耗速率之比应为1:2,根据图像,能表示反应达到平衡状态的对应的两个点是B和D,
故答案为:BD。
(4)NO2、O2和熔融KNO3可制作燃料电池,NO2作燃料、O2作氧化剂,所以石墨I为负极、石墨II为正极,石墨I电极上生成氧化物Y,因为负极上失电子,所以Y是N2O5,
故答案为:N2O5。

 名校通行证有效作业系列答案
名校通行证有效作业系列答案【题目】化学反应的本质是旧化学键的断裂和新化学键的形成。已知某些化学键的键能数据如下:
化学键 | H—H | Cl—Cl | H—Cl |
键能/(kJ·mol-1) | 436 | 243 | 431 |
则下列热化学方程式不正确的是( )
A.![]() H2(g)+
H2(g)+![]() Cl2(g)=HCl(g) ΔH=-91.5kJ·mol-1
Cl2(g)=HCl(g) ΔH=-91.5kJ·mol-1
B.H2(g)+Cl2(g)=2HCl(g) ΔH=-183kJ·mol-1
C.![]() H2(g)+
H2(g)+![]() Cl2(g)=HCl(g) ΔH=+91.5kJ·mol-1
Cl2(g)=HCl(g) ΔH=+91.5kJ·mol-1
D.2HCl(g)=H2(g)+Cl2(g) ΔH=+183kJ·mol-1