题目内容
【题目】硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。
(1)SiO2是玻璃的主要成分之一,SiO2与氢氧化钠溶液反应的化学方程为_________________________,工艺师常用____________(填物质名称)来雕刻玻璃,其所对应的方程式为___________
(2)用Na2SiO3溶液浸泡过的棉花不易燃烧,则Na2SiO3可作生产_______________的原料。
(3)工业上常用2C+SiO2![]() Si+2CO↑制备硅单质,该反应中所含元素化合价升高的物质是____________(填化学式,下同),氧化剂是________________。
Si+2CO↑制备硅单质,该反应中所含元素化合价升高的物质是____________(填化学式,下同),氧化剂是________________。
【答案】SiO2+2NaOH=Na2SiO3+H2O 氢氟酸 4HF+SiO2=SiF4↑+2H2O 防火剂 C SiO2
【解析】
(1)在常温下,NaOH与玻璃塞中的SiO2缓慢地发生反应生成Na2SiO3和H2O;氢氟酸能与玻璃反应生成四氟化硅气体;
(2)水玻璃是矿物胶,不燃烧;
(3)在化学反应中元素化合价升高的反应物是还原剂,元素的化合价降低的反应物是氧化剂。
(1)NaOH与玻璃塞中的SiO2缓慢地发生反应生成Na2SiO3和H2O:SiO2+2NaOH=Na2SiO3+H2O,氢氟酸与玻璃发生的反应为:4HF+SiO2=SiF4↑+2H2O;
(2)水玻璃是矿物胶,不燃烧,而将硅酸钠浸泡棉花就阻隔了棉花与空气中氧气的直接接触,可用作防火剂的原料;
(3)碳元素化合价升高,硅元素化合价降低,二氧化硅是氧化剂。

【题目】NO2是大气污染物,但只要合理利用也是重要的资源。回答下列问题:
(1)NO2可以被NaOH溶液捕获生成两种钠盐,溶液呈碱性,写出反应的化学方程式______________,已知常温下,HNO2的电离平衡常数为Ka=5.0×10-4,则0.1mo/L NaNO2中c(OH-)=_____________(已知![]() )
)
(2)2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步,反应情况如下表:
2NO2(g)的反应历程分两步,反应情况如下表:
反应 | 速率表达式 | 反应热 |
反应I:2NO(g) |
| △H1<0 |
反应II:N2O2(g)+O2(g) |
| △H2<0 |
反应2NO(g)+O2(g) ![]() 2NO2(g)的△H______(用△H1、△H2表示)。一定温度下,反应2NO(g)+O2(g)
2NO2(g)的△H______(用△H1、△H2表示)。一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,若升高温度,K将____(填“增大”、“减小”或“不变”),平衡常数的表达式K=____(用
2NO2(g)达到平衡状态,若升高温度,K将____(填“增大”、“减小”或“不变”),平衡常数的表达式K=____(用![]() 、
、![]() 、
、![]() 、
、![]() 表示)
表示)
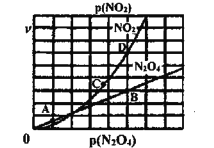
(3)反应N2O4(g) ![]() 2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强关系为:υ(N2O4)=k1· p(N2O4),υ(NO2)=k2· p(NO2),其中
2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强关系为:υ(N2O4)=k1· p(N2O4),υ(NO2)=k2· p(NO2),其中![]() 、
、![]() 是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态对应的两个点是___________
是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态对应的两个点是___________
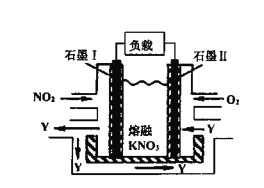
(4)NO2、O2和熔融KNO3可制作燃料电池,其原理如图,该电池在使用过程中石墨I电极上生成氧化物Y,Y可循环使用。Y的化学式为____________