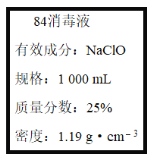
题目内容
【题目】800℃时在2L密闭容器内反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)达平衡时NO的转化率_________________。
(2)下图中表示NO2的变化的曲线是________,用O2表示从0~2s内该反应的平均速率v(O2)=____________。

(3)能说明该反应一定达到平衡状态的是_____________。
a.v(NO2)=2v(O2) b.容器内颜色保持不变
c.2v逆(NO)=v正(O2) d.容器内压强保持不变
(4)能增大该反应的反应速率的是___________________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
【答案】 65% b 1.5×10—3mol·L-1·s-1 bd bcd
【解析】(1)NO的转化率等于平衡时消耗的NO的物质的量与起始时NO的物质的量的比值;
(2)计算平衡时NO2的物质的量结合图像判断;根据v=△c/△t计算;
(3)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。
(4)根据外界条件对反应速率的影响分析。
(1)根据表中数据可知达平衡时消耗NO的物质的量是0.02mol-0.007mol=0.013mol,所以NO的转化率为0.013mol/0.020mol×100%=65%;
(2)反应是从正反应方向开始的,NO的起始浓度是0.02mol÷2L=0.010mol/L。NO的平衡浓度是0.007mol÷2L=0.0035mol/L,根据方程式可知平衡时生成的NO2的浓度是0.01mol/L-0.0035mol/L=0.0065mol/L,故图中表示NO2的变化的曲线是b。从0~2s内消耗NO是0.02mol-0.008mol=0.012mol,则根据方程式可知消耗氧气是0.012mol÷2=0.006mol,浓度是0.006mol÷2L=0.003mol/L,则v(O2)=0.003mol/L÷2s=1.5×10—3mol·L-1·s-1;
(3)a.在任何时刻都存在v(NO2)=2v(O2),所以不一定达到平衡,a错误;
b.若容器内颜色保持不变,则NO2的浓度不变,反应达到平衡状态,b正确;
c.在任何时刻都存在v逆(NO)=2V逆(O2),若2v逆(NO)=v正(O2),则v正(O2)=4v逆(O2),反应未达到平衡,c错误;
d.由于该反应是反应前后气体体积不等的反应,所以若容器内压强保持不变,则反应达到平衡,d正确。
答案选bd;
(4)a.及时分离出NO2气体,由于物质的浓度减小,所以化学反应速率减慢,a错误;
b.适当升高温度,可以加快反应速率,b正确;
c.增大反应物O2的浓度,可以加快化学反应速率,c正确;
d.选择高效催化剂,可以成千上万倍的加快化学反应速率,d正确。
答案选bcd。

 阅读快车系列答案
阅读快车系列答案【题目】铬铁矿(FeCr2O4)中含有Al2O3、Fe2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的工艺流程示意图如下(部分操作和条件略):
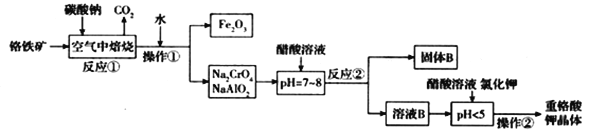
(1)反应①中,焙烧时所用的仪器材质应选用_______(填“瓷质”、“铁质”或“石英质”)。
(2)反应①中发生了两个主要反应,其中一个主要反应的化学方程式为4FeCr2O4 + 8Na2CO3 + 7O2![]() 8Na2CrO4+2Fe2O3+8CO2;另一个主要反应的化学方程式为 ____________________。
8Na2CrO4+2Fe2O3+8CO2;另一个主要反应的化学方程式为 ____________________。
(3)加入醋酸溶液,调节溶液的pH < 5时,发生的反应是___________(写离子方程式).
(4)下表是相关物质的溶解度数据:
物质 | 溶解度( g / 100 g H2O ) | ||
0 ℃ | 40 ℃ | 80 ℃ | |
KCl | 28 | 40.1 | 51.3 |
NaCl | 35.7 | 36.4 | 38 |
K2Cr2O7 | 4.7 | 26.3 | 73 |
Na2Cr2O7 | 163 | 215 | 376 |
①调节pH < 5后,加入KCl固体经一系列操作析出K2Cr2O7晶体的理由是______________。
②获得K2Cr2O7晶体的操作由多步组成,依次是加入KCl固体、蒸发浓缩、________________、_____________、洗涤、干燥得到晶体。
(5)酸性溶液中过氧化氢能使Cr2O72生成蓝色的CrO5,该反应可用来检验Cr2O72的存在。已知该反应是非氧化还原反应,写出反应的离子方程式:________________,CrO5分子结构中过氧键的数目是_____________。