题目内容
【题目】元素周期表的形式多种多样,下图是扇形元素周期表的一部分(1-36号元素),对比中学常见元素周期表,思考扇形元素周期表的填充规律,并回答下列问题:
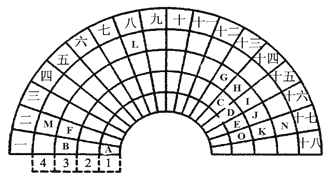
(1) D代表的元素处于常见元素周期表的位置是第 _____ 周期________ 族。
(2)元素F、G、I、K、M的原子半径由大到小的顺序是___________________(用元素符号表示)。
(3)B、F、G三种元素三种元素最高价氧化物对应水化物碱性最强的碱是_________(填化学式)。
【答案】第二周期 ⅤA 族 Ca>Mg>Al>P>Cl NaOH
【解析】
A在第一周期第一列,A是H元素;B在第三周期第一列,B是Na元素;C、D、E、O分别在第二周期第14、15、16、17列,C、D、E、O分别是C、N、O、F元素;
F、G、H、I、J、K分别在第三周期第2、13、14、15、16、17列,F、G、H、I、J、K分别是Mg、Al、Si、P、S、Cl元素;M、L、N分别在第四周期第2、8、17列,M、L、N分别是Ca、Fe、Br。
根据以上分析,(1) D是N元素,处于常见元素周期表的位置是第二周期ⅤA 族。
(2)元素F、G、I、K、M分别是Mg、Al、P、Cl、Ca,电子层数越多半径越大,电子层数相同时,质子数越多半径越小,原子半径由大到小的顺序是Ca>Mg>Al>P>Cl。
(3)B、F、G三种元素分别是Na、Mg、Al,三种元素都处于第三周期,金属性由强到弱的顺序为Na>Mg>Al,金属性越强,元素最高价氧化物对应水化物碱性越强,碱性最强的碱是NaOH。

 阅读快车系列答案
阅读快车系列答案【题目】800℃时在2L密闭容器内反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)达平衡时NO的转化率_________________。
(2)下图中表示NO2的变化的曲线是________,用O2表示从0~2s内该反应的平均速率v(O2)=____________。

(3)能说明该反应一定达到平衡状态的是_____________。
a.v(NO2)=2v(O2) b.容器内颜色保持不变
c.2v逆(NO)=v正(O2) d.容器内压强保持不变
(4)能增大该反应的反应速率的是___________________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂