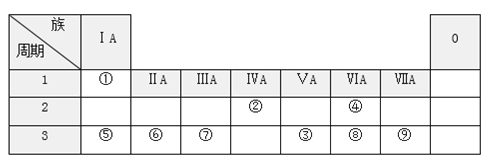
题目内容
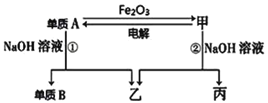
【题目】铬铁矿(FeCr2O4)中含有Al2O3、Fe2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的工艺流程示意图如下(部分操作和条件略):
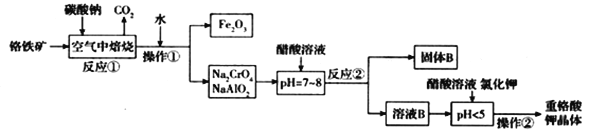
(1)反应①中,焙烧时所用的仪器材质应选用_______(填“瓷质”、“铁质”或“石英质”)。
(2)反应①中发生了两个主要反应,其中一个主要反应的化学方程式为4FeCr2O4 + 8Na2CO3 + 7O2![]() 8Na2CrO4+2Fe2O3+8CO2;另一个主要反应的化学方程式为 ____________________。
8Na2CrO4+2Fe2O3+8CO2;另一个主要反应的化学方程式为 ____________________。
(3)加入醋酸溶液,调节溶液的pH < 5时,发生的反应是___________(写离子方程式).
(4)下表是相关物质的溶解度数据:
物质 | 溶解度( g / 100 g H2O ) | ||
0 ℃ | 40 ℃ | 80 ℃ | |
KCl | 28 | 40.1 | 51.3 |
NaCl | 35.7 | 36.4 | 38 |
K2Cr2O7 | 4.7 | 26.3 | 73 |
Na2Cr2O7 | 163 | 215 | 376 |
①调节pH < 5后,加入KCl固体经一系列操作析出K2Cr2O7晶体的理由是______________。
②获得K2Cr2O7晶体的操作由多步组成,依次是加入KCl固体、蒸发浓缩、________________、_____________、洗涤、干燥得到晶体。
(5)酸性溶液中过氧化氢能使Cr2O72生成蓝色的CrO5,该反应可用来检验Cr2O72的存在。已知该反应是非氧化还原反应,写出反应的离子方程式:________________,CrO5分子结构中过氧键的数目是_____________。
【答案】铁质 Na2CO3+ Al2O3 ![]() 2NaAlO2 + CO2↑ 2CrO42-+2H+
2NaAlO2 + CO2↑ 2CrO42-+2H+ ![]() Cr2O72-+H2O K2Cr2O7的溶解度比Na2Cr2O7小,且温度对氯化钠的溶解度影响较小,但对重铬酸钾的溶解度影响较大,利用复分解反应在低温下可以得到重铬酸钾 冷却结晶 过滤 Cr2O72+4H2O2+2H+=2CrO5+5H2O 2
Cr2O72-+H2O K2Cr2O7的溶解度比Na2Cr2O7小,且温度对氯化钠的溶解度影响较小,但对重铬酸钾的溶解度影响较大,利用复分解反应在低温下可以得到重铬酸钾 冷却结晶 过滤 Cr2O72+4H2O2+2H+=2CrO5+5H2O 2
【解析】
根据流程图,铬铁矿(FeCr2O4)中含有Al2O3、Fe2O3等杂质,将铬铁矿和碳酸钠混合在空气中充分焙烧,放出二氧化碳,焙烧后的固体加水浸取,分离得到Na2CrO4和NaAlO2溶液和氧化铁固体,说明煅烧发生的反应有4FeCr2O4 + 8Na2CO3 + 7O2![]() 8Na2CrO4+2Fe2O3+8CO2、Na2CO3+ Al2O3
8Na2CrO4+2Fe2O3+8CO2、Na2CO3+ Al2O3 ![]() 2NaAlO2 + CO2↑;向Na2CrO4和NaAlO2溶液中加入醋酸调pH约7~8,分离得到溶液B和固体B;再向溶液B中继续加醋酸酸化,使溶液pH小于5,再加入氯化钾,经过操作②得到重铬酸钾晶体,说明溶液B中含有重铬酸钠,固体B为偏铝酸钠与醋酸反应生成的氢氧化铝。据此分析解答。
2NaAlO2 + CO2↑;向Na2CrO4和NaAlO2溶液中加入醋酸调pH约7~8,分离得到溶液B和固体B;再向溶液B中继续加醋酸酸化,使溶液pH小于5,再加入氯化钾,经过操作②得到重铬酸钾晶体,说明溶液B中含有重铬酸钠,固体B为偏铝酸钠与醋酸反应生成的氢氧化铝。据此分析解答。
(1)反应①中,碳酸钠高温下能够与二氧化硅反应,因此焙烧时所用的仪器材质应选用铁质,故答案为:铁质;
(2)根据上述分析,反应①中发生了两个主要反应,其中一个主要反应的化学方程式为4FeCr2O4 + 8Na2CO3 + 7O2![]() 8Na2CrO4+2Fe2O3+8CO2;另一个主要反应的化学方程式为Na2CO3+ Al2O3
8Na2CrO4+2Fe2O3+8CO2;另一个主要反应的化学方程式为Na2CO3+ Al2O3 ![]() 2NaAlO2 + CO2↑,故答案为:Na2CO3+ Al2O3
2NaAlO2 + CO2↑,故答案为:Na2CO3+ Al2O3 ![]() 2NaAlO2 + CO2↑;
2NaAlO2 + CO2↑;
(3) 重铬酸钾溶液中存在如下平衡:2CrO42-+2H+Cr2O72-+H2O,加入醋酸溶液,调节溶液的pH < 5时,使平衡正向移动,故答案为:2CrO42-+2H+Cr2O72-+H2O;
(4)①调节pH < 5后,根据表格数据可知,K2Cr2O7的溶解度比Na2Cr2O7小,且温度对氯化钠的溶解度影响较小,但对重铬酸钾的溶解度影响较大,加入KCl固体,利用复分解反应在低温下可以得到重铬酸钾,经一系列操作析出K2Cr2O7晶体,故答案为:K2Cr2O7的溶解度比Na2Cr2O7小,且温度对氯化钠的溶解度影响较小,但对重铬酸钾的溶解度影响较大,利用复分解反应在低温下可以得到重铬酸钾;
②获得K2Cr2O7晶体的操作由多步组成,依次是加入KCl固体、利用复分解反应在低温下可以得到重铬酸钾,然后通过蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到重铬酸钾晶体,故答案为:冷却结晶;过滤;
(5)酸性溶液中过氧化氢能使Cr2O72生成蓝色的CrO5,该反应可用来检验Cr2O72的存在。由于该反应是非氧化还原反应,因此铬元素的化合价和双氧水中O元素的化合价不变,说明CrO5中存在-2价和-1价是O,反应的离子方程式为Cr2O72+4H2O2+2H+=2CrO5+5H2O,铬元素的化合价为+6价,根据正负化合价的代数和为0,CrO5分子结构中含有1个-2价是O和4个-1价的O,合2个过氧键,因此过氧键的数目是2,故答案为:Cr2O72+4H2O2+2H+=2CrO5+5H2O;2。

【题目】800℃时在2L密闭容器内反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)达平衡时NO的转化率_________________。
(2)下图中表示NO2的变化的曲线是________,用O2表示从0~2s内该反应的平均速率v(O2)=____________。

(3)能说明该反应一定达到平衡状态的是_____________。
a.v(NO2)=2v(O2) b.容器内颜色保持不变
c.2v逆(NO)=v正(O2) d.容器内压强保持不变
(4)能增大该反应的反应速率的是___________________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
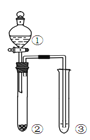
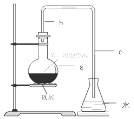
【题目】利用右图所示装置进行下列实验,能得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 | 实验装置 |
A | 稀硫酸 | Na2S | AgNO3与AgCl的溶液 | Ksp(AgCl)>Ksp(Ag2S) |
|
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2 溶液 | SO2与可溶性钡盐均可以生成白色沉淀 | |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
A. A B. B C. C D. D