题目内容
4. 常温时,向20mL 0.1mol•L-1醋酸溶液中滴加0.1mol•L-1NaOH溶液,滴定曲线如图所示.下列有关说法正确的是( )
常温时,向20mL 0.1mol•L-1醋酸溶液中滴加0.1mol•L-1NaOH溶液,滴定曲线如图所示.下列有关说法正确的是( )| A. | a点时升高温度,溶液pH增大 | |
| B. | b点c(CH3COO-)<c(CH3COOH) | |
| C. | c点对应的NaOH溶液的体积V=20mL | |
| D. | d点c(Na+)-c(CH3COO-)=9.9×10-7mol•L-1 |
分析 A、升高温度,促进醋酸的电离;
B、在b点时,加入10mL0.1mol/L的氢氧化钠溶液,得等浓度的CH3COOH和CH3COONa的混合溶液;
C、当加入20mL0.1mol/L的氢氧化钠溶液时,能将醋酸恰好完全反应得CH3COONa,溶液显碱性;
D、在d点时,溶液的pH=8,求出溶液中C(H+)和C(OH-),根据溶液的电荷守恒来计算.
解答 解:A、弱电解质的电离吸热,故升高温度,促进醋酸的电离,溶液中c(H+)增大,则pH变小,故A错误;
B、在b点时,加入10mL0.1mol/L的氢氧化钠溶液,得等浓度的CH3COOH和CH3COONa的混合溶液,根据“电离大于水解”的规律可知,溶液中醋酸的电离程度大于CH3COO-的水解程度:CH3COOH?CH3COO-+H+ ①
CH3COO-+H2O?CH3COOH+OH-②
由于①>②,故溶液中的c(CH3COO-)>c(CH3COOH),故B错误;
C、当加入20mL0.1mol/L的氢氧化钠溶液时,能将醋酸恰好完全反应得CH3COONa,溶液显碱性,故若使c点溶液呈中性,则需加入的氢氧化钠溶液小于20mL,故C错误;
D、在d点时,溶液的pH=8,则溶液中c(H+)=10-8mol/L,c(OH-)=10-6mol/L,根据溶液的电荷守恒可知:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),则有:c(Na+)-c(CH3COO-)=c(OH-)-c(H+)=9.9×10-7mol•L-1,故D正确.
故选D.
点评 本题考查了酸碱中和滴定过程中的离子浓度大小的比较以及溶液中的离子守恒,综合性较强,难度适中.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
17.下列关于有机化合物的说法正确的是( )
| A. | 聚氯乙烯分子中含碳碳双键 | B. | 以淀粉为原料可制取乙酸乙酯 | ||
| C. | 丁烷有3种同分异构体 | D. | 油脂的皂化反应属于加成反应 |
15.C、O、Si、Cl、Na、Fe是中学化学中常见的六种元素.
(1)Si位于元素周期表第三周期第ⅣA族,Fe2+的离子结构示意图为 ,Cl的基态原子外围电子层排布式为3s23p5;
,Cl的基态原子外围电子层排布式为3s23p5;
(2)用“>”或“<”填空:
(3)氯的一种常见含氧酸有漂白性,它与H2CO3酸性强弱不同,写出可以证明此结论一个化学方程式Ca(ClO)2+CO2+H2O═CaCO3+2HClO;
(4)黄绿色气体二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂.工业上常利用氯酸钠和浓盐酸来制备ClO2,同时还得到一种黄绿色的气体单质、一种无色液体和一种常见离子化合物.写出该反应的化学方程式,并标出电子转移的方向和数目: ;
;
(5)Ti倍称为继铁铝之后“21世纪”金属,应用前景很广.钛铁矿(FeTiO3)可被一氯化碳还原为铁和TiO2固体.在25℃、101KPa下,已知煤消耗7克CO,吸收aKJ热量,该反应的热化学方程式为FeTiO3(s)+CO(g)=TiO2(s)+Fe(s)+CO2(g))△H=+4aKJ•mol-1.
(1)Si位于元素周期表第三周期第ⅣA族,Fe2+的离子结构示意图为
 ,Cl的基态原子外围电子层排布式为3s23p5;
,Cl的基态原子外围电子层排布式为3s23p5;(2)用“>”或“<”填空:
| 第一电离能 | 键能 | 沸点 |
| O>Na | H-Cl>H-Si | CO2<H2O |
(4)黄绿色气体二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂.工业上常利用氯酸钠和浓盐酸来制备ClO2,同时还得到一种黄绿色的气体单质、一种无色液体和一种常见离子化合物.写出该反应的化学方程式,并标出电子转移的方向和数目:
 ;
;(5)Ti倍称为继铁铝之后“21世纪”金属,应用前景很广.钛铁矿(FeTiO3)可被一氯化碳还原为铁和TiO2固体.在25℃、101KPa下,已知煤消耗7克CO,吸收aKJ热量,该反应的热化学方程式为FeTiO3(s)+CO(g)=TiO2(s)+Fe(s)+CO2(g))△H=+4aKJ•mol-1.
12.短周期元素R、T、X、Y、Z在元素周期表的相对位置如图所示,它们的最外层电子数之和为24.则下列判断正确的是( )
| R | T | |
| X | Y | Z |
| A. | R位于元素周期表中第二周期第VA族 | |
| B. | R能分别与X、Z形成共价化合物 | |
| C. | 气态氢化物稳定性:Y>T | |
| D. | Z元素的最高价氧化物对应的水化物的化学式为HZO4 |
16.某化合物的结构式(键线式)及球棍模型如图1:该有机分子的核磁共振氢谱图如图2(单位:ppm):

下列关于该有机物的叙述正确的是( )

下列关于该有机物的叙述正确的是( )
| A. | 该有机物不同化学环境的氢原子有4种 | |
| B. | 该有机物属于芳香族化合物 | |
| C. | 键线式中的Et代表的基团为-CH3 | |
| D. | 该有机物在一定条件下能够发生取代反应 |
13.如图是部分短周期主族元素原子半径与原子序数的关系图.下列说法错误的是( )


| A. | X、R的最高化合价相同 | |
| B. | 简单离子的半径:Y>Z>X | |
| C. | Y、Z、R对应的最高价氧化物的水化物相互之间可以发生反应 | |
| D. | 电解熔融的X与Z构成的化合物可以得到单质Z |
14.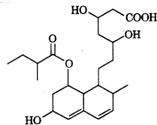 普伐他汀是一种调节血脂的药物,其结构简式如图所示.下列关于普伐他汀的描述错误的是( )
普伐他汀是一种调节血脂的药物,其结构简式如图所示.下列关于普伐他汀的描述错误的是( )
 普伐他汀是一种调节血脂的药物,其结构简式如图所示.下列关于普伐他汀的描述错误的是( )
普伐他汀是一种调节血脂的药物,其结构简式如图所示.下列关于普伐他汀的描述错误的是( )| A. | 分子中含有四种官能团 | |
| B. | 1 mol该物质最多可与3 mol NaOH反应 | |
| C. | 能发生加成反应、取代反应、水解反应 | |
| D. | 1 mol该物质最多可与2 mol H2发生加成反应 |
 b.
b. c.
c.
 b.
b. c.CH3OCH3
c.CH3OCH3 b.
b. c.
c.
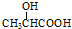 )有良好的防腐保鲜功效,广泛应用于食品行业.
)有良好的防腐保鲜功效,广泛应用于食品行业.
 ,
, .
.