题目内容
【题目】不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2 , 也可被还原为氢气.为了验证这一事实,某同学拟用下图装置进行实验(实验时压强为101 kPa,温度为0℃).
(1)若在烧瓶中放入1.30g锌粒,与c mol/L H2SO4反应,为保证实验结论的可靠,量气管的适宜规格是 .
A.200mL
B.400mL
C.500mL
(2)若1.30g锌粒完全溶解,测得盛氢氧化钠溶液的洗气瓶增重1.28g,则圆底烧瓶中发生反应的化学方程式为: .
(3)若烧瓶中投入a g锌且完全反应,氢氧化钠洗气瓶增重b g量气管中收集到VmL气体,其依据得失电子守恒的原理,可得出a、b、V之间的关系为:是 .
(4)若在烧瓶中投入d g锌,再加入VL c mol/L 浓硫酸,充分反应后锌有剩余,测得盛氢氧化钠溶液的洗气瓶增重m g,则整个实验过程产生的混和气体中H2和SO2物质的量之比 ![]() =(用含字母的代数式表示).若撤走盛有无水氯化钙的U型管,
=(用含字母的代数式表示).若撤走盛有无水氯化钙的U型管, ![]() 的比值将(填偏大、偏小或无影响)
的比值将(填偏大、偏小或无影响)
【答案】
(1)C
(2)Zn+2H2SO4(浓) ![]() ZnSO4+SO2↑+2H2O
ZnSO4+SO2↑+2H2O
(3)![]() =
= ![]() +
+ ![]()
(4)![]() ,偏小
,偏小
【解析】解:(1)
Zn+H2SO4=ZnSO4+ | H2↑ |
1mol | 22.4L |
![]() =0.02mol 0.448L
=0.02mol 0.448L
0.448L=448mL,则量气管的规格应该选500mL,
所以答案是:C; (2)氢氧化钠是碱,能吸收酸性气体,氢氧化钠洗气瓶增重说明有酸性气体生成,当锌和硫酸反应时,锌作还原剂,硫酸作氧化剂,被还原为二氧化硫,由(1)计算可知,1.30g锌和硫酸反应若只生成二氧化硫,共生成0.02mol,质量为0.02mol×64g/mol=1.28g,与氢氧化钠增重的质量一致,故发生反应的化学方程式为:Zn+2H2SO4(浓) ![]() ZnSO4+SO2↑+2H2O,
ZnSO4+SO2↑+2H2O,
所以答案是:Zn+2H2SO4(浓) ![]() ZnSO4+SO2↑+2H2O;(3)根据氧化还原知识或根据方程式,1 mol锌无论用来产生SO2 还是产生氢气,都是1mol锌对应1 mol气体,根据氧化还原反应中得失电子数相等可得:
ZnSO4+SO2↑+2H2O;(3)根据氧化还原知识或根据方程式,1 mol锌无论用来产生SO2 还是产生氢气,都是1mol锌对应1 mol气体,根据氧化还原反应中得失电子数相等可得: ![]() =
= ![]() +
+ ![]() ,
,
所以答案是: ![]() =
= ![]() +
+ ![]() ;(4)
;(4)
Zn+ | 2H2SO4(浓)=ZnSO4+ | SO2↑+2H2O |
2mol | 1mol | |
|
|
则生成二氧化硫需要的硫酸为 ![]() mol;
mol;
Zn+ | H2SO4=ZnSO4+ | H2↑ |
1mol | 1mol | |
( cV﹣ | (cV﹣ |
则: ![]() =
=  =
= ![]() ;
;
若撤走盛有无水氯化钙的U型管,混合气体中的水蒸气进入氢氧化钠溶液,导致洗气瓶增重量增大,所以计算时二氧化硫的物质的量增大,氢气与二氧化硫的物质的量之比偏小,
所以答案是: ![]() ;偏小.
;偏小.

 小学夺冠AB卷系列答案
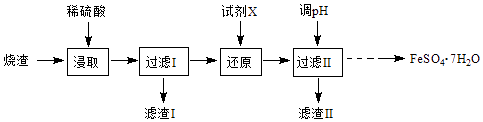
小学夺冠AB卷系列答案【题目】硼泥主要由MgO和SiO2组成,含有少量Fe2O3、FeO、Al2O3等杂质.用硼泥生产氢氧化镁的工艺流程如图所示: 
已知某些氢氧化物沉淀的pH如下表所示:
氢氧化物 | 开始沉淀时的pH | 完全沉淀时的pH |
Mg(OH)2 | 9.3 | 10.8 |
Fe(OH)2 | 7.6 | 9.6 |
Fe(OH)3 | 2.7 | 3.7 |
(1)MgO的电子式为 .
(2)滤渣2的主要成分是 , 向滤渣2中继续加入过量的NaOH溶液,发生反应的离子方程式为 .
(3)加入NaOH调节溶液pH=12.0时,发生反应的离子方程式为 .
(4)利用Mg(OH)2与含SO2的烟气反应生成MgSO4 , 可以使烟气脱硫,该反应的化学方程式为 .
(5)若取a吨硼泥为原料,最后得到b吨Mg(OH)产品(假设生产过程中镁元素无损失),则硼泥中MgO的质量分数为(用含有a、b的代数式表示).