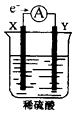
��Ŀ����
����Ŀ����ʵ�������ö������̸�Ũ���ᷴӦ�Ʊ����﴿�������������д�ʵ�飬����������ͼ��
��1������������������ȷ˳���ǣ�E�� �� �� �� �� �� ��F��
��2�����巢��װ���н��еķ�Ӧ��ѧ����ʽ������0.5mol MnO2���뷴Ӧʱ����������HCl������Ϊ �� ���ɵ�Cl2�ڱ�״���µ����ԼΪ ��
��3����װ���У��ٱ���ʳ��ˮ�������� �� ��Ũ����������� ��
��4����ѧʵ���м����Ƿ���Cl2��������ʪ��ĵ��۩�KI��ֽ�������Cl2�������ɹ۲쵽�������� �� д����Ӧ����ʽ ��
��5��д��β������װ���н��еķ�Ӧ�Ļ�ѧ����ʽ ��
���𰸡�
��1��C,D,A,B,H,G
��2��4HCl��Ũ��+MnO2 ![]() MnCl2+Cl2��+2H2O,36.5g,11.2L
MnCl2+Cl2��+2H2O,36.5g,11.2L
��3����ȥCl2�е�HCl,��������
��4����ֽ����,Cl2+2KI=I2+2KCl
��5��Cl2+2NaOH=NaCl+NaClO+H2O
���������⣺��1����ʵ�������ö������̸�Ũ���ᷴӦ�Ʊ����﴿������������Ҫ����װ�������������ñ���ʳ��ˮ��ȥ�Ȼ��⣬ͨ��Ũ�����ȥˮ�����������ܳ����̴��ռ����������������������Һ���ն����������װ������˳���� E C D A B H G F��
���Դ��ǣ�C D A B H G��
��2������������Ũ�����ڼ��������·�Ӧ�����Ȼ��̡�������ˮ����ѧ����ʽ��4HCl��Ũ��+MnO2 ![]() MnCl2+Cl2��+2H2O����Ӧ������1mol�������̣���2mol�Ȼ��ⱻ����������1mol���������Ե�0.5mol MnO2���뷴Ӧʱ����������HCl������Ϊ1mol������Ϊ36.5g���������������ʵ���Ϊ0.5mol���������������Ϊ0.5mol��22.4L/mol=11.2L��
MnCl2+Cl2��+2H2O����Ӧ������1mol�������̣���2mol�Ȼ��ⱻ����������1mol���������Ե�0.5mol MnO2���뷴Ӧʱ����������HCl������Ϊ1mol������Ϊ36.5g���������������ʵ���Ϊ0.5mol���������������Ϊ0.5mol��22.4L/mol=11.2L��
���Դ��ǣ�4HCl��Ũ��+MnO2 ![]() MnCl2+Cl2��+2H2O�� 36.5g�� 11.2L��
MnCl2+Cl2��+2H2O�� 36.5g�� 11.2L��
��3�������ӷ�����ȡ�������к����Ȼ����ˮ�����������ڱ���ʳ��ˮ���ܽ�Ȳ����Ȼ���������ˮ��ѡ��ʳ��ˮ��ȥ�����е��Ȼ��⣻
Ũ���������ˮ�ԣ�ѡ��Ũ�����������������������
���Դ��ǣ��ٳ�ȥCl2�е�HCl�� �ڸ���������
��4����������ǿ�������ԣ��ܹ������⻯�����ɵ��ʵ⣬��ѧ����ʽ����Cl2+2 KI=I2+2 KCl�����������۱�����
���Դ��ǣ���ֽ������Cl2+2 KI=I2+2 KCl��
��5������������������Һ��Ӧ�����Ȼ��ơ��������ƺ�ˮ����ѧ����ʽ��Cl2+2 NaOH=NaCl+NaClO+H2O��
���Դ��ǣ�Cl2+2 NaOH=NaCl+NaClO+H2O��
�����㾫����������Ŀ����֪����������������ʵ�����Ʒ������֪ʶ���Եõ�����Ĵ𰸣���Ҫ����ʵ�����Ʒ���MnO2+4HCl��Ũ��=MnCl2+Cl2��+2H2O��

 ��������״Ԫ��ϵ�д�
��������״Ԫ��ϵ�д� �ƸԿ�����ҵ��ϵ�д�
�ƸԿ�����ҵ��ϵ�д� ��Ԫ����ĩ��ϰ�ȷ��ϵ�д�
��Ԫ����ĩ��ϰ�ȷ��ϵ�д�����Ŀ�����ü�����ˮ��Ӧ�Ʊ���������ԭ�����۲����ʸߣ�����ʵ���ƹ��ֵ�� ��֪����CH4��g��+H2O��g��CO��g��+3H2��g����H=+206.2kJmol��1
��CO��g��+H2O��g��CO2��g��+H2��g����H=��42.3kJmol��1
��1�������ˮ�������ɶ�����̼���������Ȼ�ѧ����ʽΪ ��
��2��Ϊ��̽����Ӧ�����Է�ӦCO��g��+H2O��g��CO2��g��+H2��g����H=��42.3kJmol��1��Ӱ�죬ij�С�����������ʵ�飬ʵ��������ͼ��ʾ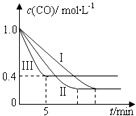
��� | �¶� | ѹǿ | cʼ��CO�� | cʼ��H2O�� |
�� | 530�� | 3MPa | 1.0molL��1 | 3.0molL��1 |
�� | X | Y | 1.0molL��1 | 3.0molL��1 |
�� | 630�� | 5MPa | 1.0molL��1 | 3.0molL��1 |
��������ʵ������ͼ�������������е�ʵ��������X=�棬Y=MPa��
��ʵ���ӿ�ʼ��ƽ�⣬��ƽ����Ӧ�ٶ���v ��CO��=molL��1min��1 ��
��ʵ����ƽ��ʱCO��ת����ʵ����ƽ��ʱCO��ת���ʣ�����ڡ�����С�ڡ����ڡ�����
����530��ʱ��ƽ�ⳣ��K=1������10L������Ͷ��2.0mol CO��g����2.0mol H2O��g����1.0mol CO2��g����1.0mol H2��g������ʱ��ѧ��Ӧ������������������� �ƶ���
����Ŀ��ijС������֤��Ӧ��Fe+2Ag+=Fe2++2Ag����ʵ���м�Fe3+ �� ���ֺ�̽���������£�
�������ữ��0.05molL��1��������Һ��pH��2���м���������ۣ�������ã��ձ��ײ��к�ɫ���壬��Һ�ʻ�ɫ��
��1���������
��ȡ������ɫ���壬ϴ�Ӻ��������������֤����ɫ�����к���Ag��
��ȡ�ϲ���Һ���μ�K3[Fe��CN��6]��Һ��������ɫ������˵����Һ�к��� ��
��2����ԡ���Һ�ʻ�ɫ��������Ϊ��Һ����Fe3+ �� ����Ϊ���۹���ʱ��������Fe3+ �� �����ݵ�ԭ�����������ӷ���ʽ��ʾ����������ֹ۵����ʵ�飺
��ȡ�ϲ���Һ���μ�KSCN��Һ����Һ��죬֤ʵ�˼IJ²⣮ͬʱ�����а�ɫ��������������Һ��ɫ��dz��������������ȡ��ʱ���йأ��Ա�ʵ���¼���£�
��� | ȡ��ʱ��/min | ���� |
�� | 3 | ����������ɫ��������Һ�ʺ�ɫ |
�� | 30 | ������ɫ��������3minʱ��С����Һ��ɫ��3minʱ���� |
�� | 120 | ������ɫ��������30minʱ��С����Һ��ɫ��3 0minʱ��dz |
�����ϣ�Ag+��SCN�����ɰ�ɫ����AgSCN��
�ڶ�Fe3+������ԭ���������¼��裺
����a�����������۱����������㣬�ܲ���Fe3+��
����b�������д���O2 �� �����������ӷ���ʽ��ʾ�����ɲ���Fe3+��
����c��������Һ��NO3�����������ԣ��ɲ���Fe3+��
����d�����������ж���Һ�д���Ag+ �� �ɲ���Fe3+ ��
������ʵ����֤ʵ����a��b��c���Dz���Fe3+����Ҫԭ��ʵ����֤ʵ����d������
ʵ����������ữ����Һ��pH��2���м���������ۣ�������ã���ͬʱ��ȡ�ϲ���Һ�μ�KSCN��Һ��3minʱ��Һ��dz��ɫ��30min����Һ������ɫ��
ʵ���װ����ͼ�����м���Һ�� �� ���������� �� 
��3������ʵ������Ϸ���ʽ�Ʋ�ʵ�颡������Fe3+Ũ�ȱ仯��ԭ�� ��