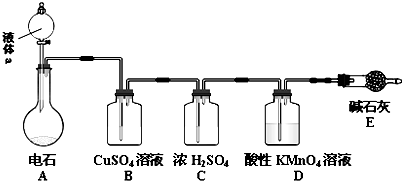
题目内容
19.下列叙述正确的是( )| A. | 同周期主族元素的原子半径以ⅦA族的为最大 | |
| B. | 在周期表中零族元素的单质常温常压下全部是气体 | |
| C. | ⅠA、ⅡA族元素的原子,其半径越大就越容易得电子 | |
| D. | 非金属元素的最低负价都和它的族序数相等 |
分析 A.同周期主族元素从左向右逐渐减小;
B.零族元素的单质为稀有气体;
C.ⅠA、ⅡA族元素的原子,若在同周期,IA的易失去电子;
D.非金属元素的最高正价等于族序数.
解答 解:A.同周期主族元素从左向右逐渐减小,则同周期主族元素的原子半径以IA族最大,ⅦA族的为最小,故A错误;
B.单质常温常压下,零族元素的单质为稀有气体,均为气体,故B正确;
C.ⅠA、ⅡA族元素的原子,若在同周期,IA的易失去电子,如Na比Mg易失去电子,Na的原子半径比Mg的原子半径大,故C错误;
D.非金属元素的最高正价等于族序数,非金属元素的最低负价等于它的族序数-8,故D错误;
故选B.
点评 本题考查元素周期表的结构与应用,为高频考点,把握位置、性质及原子结构的关系为解答的关键,侧重分析与应用能力的考查,注意选项C为解答的易错点,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.a mol FeS与b mol FeO投入到V L、c mol•L-1的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看做是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为( )
①(a+b)×63g ②(a+b)×189g ③3(a+b) mol ④(Vc-$\frac{9a+b}{3}$)mol.
①(a+b)×63g ②(a+b)×189g ③3(a+b) mol ④(Vc-$\frac{9a+b}{3}$)mol.
| A. | ②④ | B. | ②③④ | C. | ②③ | D. | ①②③④ |
7.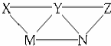 KHSO4、BaCl2、Na2CO3、FeSO4和氯水五种溶液,有如图所示的相互反应,图中每条连线两端的物质可以发生化学反应.下列说法不合理的是( )
KHSO4、BaCl2、Na2CO3、FeSO4和氯水五种溶液,有如图所示的相互反应,图中每条连线两端的物质可以发生化学反应.下列说法不合理的是( )
 KHSO4、BaCl2、Na2CO3、FeSO4和氯水五种溶液,有如图所示的相互反应,图中每条连线两端的物质可以发生化学反应.下列说法不合理的是( )
KHSO4、BaCl2、Na2CO3、FeSO4和氯水五种溶液,有如图所示的相互反应,图中每条连线两端的物质可以发生化学反应.下列说法不合理的是( )| A. | X可能为KHSO4 | B. | M不可能是BaCl2 | C. | Y一定为Na2CO3 | D. | N可能是FeSO4 |
14.两种气态烃的混合物共0.1mol,完全燃烧后生成3.58L(标准状况)二氧化碳和3.6克水,下列说法正确的是( )
| A. | 一定含有乙烯 | B. | 一定含有甲烷和乙烯 | ||
| C. | 一定含有甲烷 | D. | 无法确定 |
11.在一定温度下,将6mol CO2和8mol H2充入2L恒容密闭容器中,发生如下反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<O
分别在t时测得在该容器内n(H2)的数值如下:
则下列说法正确的是( )
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<O
分别在t时测得在该容器内n(H2)的数值如下:
| t/min | 1 | 4 | 8 | 11 |
| n(H2)/mol | 6 | 2.6 | 2 | 2 |
| A. | 该温度下,平衡常数K=0.5 | |
| B. | 反应进行4min时,V(C02)=0.45 mol/(L•min) | |
| C. | 反应进行到9min时,H2的转化率比8min时高 | |
| D. | 反应进行11min后,若增大容器内压强,CO2的转化率一定增大 |
8.向某盛有7.8gNa2O2的密闭容器中(无空气)通入4.48LNO2(标准状况),然后注入200mL水,充分反应后,容器中所含物质有( )
| A. | NaNO2 NO H2O | B. | NaNO3 NaOH O2 H2O | ||
| C. | NaNO3 H2O | D. | NaNO3 HNO3 O2 H2O |
9.下列热化学方程式书写正确的是(△H的绝对值均正确)( )
| A. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g);△H=-1367.0 kJ/mol | |
| B. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=+57.3kJ/mol | |
| C. | S(s)+O2(g)═SO2(g);△H=-296.8kJ/mol | |
| D. | 2NO2═O2+2NO;△H=+116.2kJ/mol |