题目内容
【题目】写出下列各烷烃的分子式。
(1)烷烃A在同温同压下蒸气的密度是H2的43倍:________。
(2)烷烃B的碳原子数是5:________。
(3)分子中含有26个电子的烷烃C:________。
(4)室温下相对分子质量最大的气态直链烷烃D:________。
【答案】C6H14 C5H12 C3H8 C4H10
【解析】
烷烃的通式CnH(2n+2),据此分析;
(1)根据密度之比等于摩尔质量之比进行计算;
(2)根据烷烃的通式和B的分子中含有5个碳原子,计算氢原子的个数,写出分子式;
(3)一个碳原子中有6个电子,一个氢原子中有1个电子,结合通式列式计算出n,写出分子式;
(4)室温下相对分子质量最大的气态直链烷烃为正丁烷,以此书写分子式。
烷烃的通式为:CnH(2n+2),烷烃的相对分子量为:14n+2。
(1)密度之比等于摩尔质量之比,就等于相对分子量之比,A的相对分子质量为:14n+2=86,n=6,即该烷烃的分子式为C6H14。
(2)烷烃B的分子中含有5个碳原子,即2n+2=2![]() 5+2=12,所以B的分子式为C5H12;
5+2=12,所以B的分子式为C5H12;
(3)由CnH(2n+2),可知,6n+2n+2=26,n=3,该烷烃的分子式为C3H8;
(4)室温下相对分子质量最大的气态直链烷烃应为CH3CH2CH2CH3,分子式为C4H10。

练习册系列答案
相关题目
【题目】实验室为探究铁与浓硫酸(足量)的反应,并验证SO2的性质,设计如图所示装置进行实验,下列说法不正确的是( )
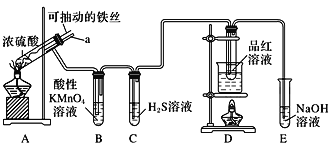
A.装置B中酸性KMnO4溶液逐渐褪色,体现了二氧化硫的还原性 |
B.实验结束后可向装置A的溶液中滴加KSCN溶液以检验生成的Fe3+ |
C.装置D中品红溶液褪色可以验证SO2的漂白性 |
D.实验时将导管a插入浓硫酸中,可防止装置B中的溶液倒吸 |




