题目内容
【题目】回答下列问题
学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理请回答下列问题:
(1)常温下,某纯碱溶液中滴入酚酞,溶液呈红色,则该溶液呈 ______性,原因是________________;用离子方程式表示
(2)在常温下将pH=2的盐酸10mL加水稀释到1L,则稀释后的溶液的pH值等于 ______________;
(3)已知在H2S溶液中存在下列平衡: H2S![]() H++HS-
H++HS-
向H2S溶液中加入NaOH固体时,不考虑温度变化电离平衡向______移动,填“左”或“右”),c(H+)______。(填“增大”、“减小”或“不变”
向H2S溶液中加入NaHS固体时,电离平衡向______移动,填“左”或“右”)c(S2—)______。(填“增大”、“减小”或“不变”)
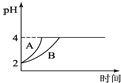
(4)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是 ______ 填“A”或“B”;设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2,则m1______ m2。 (选填“![]() ”、“
”、“![]() ”、“
”、“![]() ”
”
【答案】碱 CO32-+H2O ![]() HCO3-+OH- 4 右 减小 左 增大 B <
HCO3-+OH- 4 右 减小 左 增大 B <
【解析】
化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理:如果改变影响平衡的条件之一(如温度、压强、参加反应的化学物质的浓度)平衡将向着能够减弱这种改变的方向移动,称之为勒夏特列原理;(1)纯碱属于强碱弱酸盐,从水解平衡角度分析;(2)根据稀释前后盐酸的H+物质的量不变计算稀释后溶液中c(H+),再用pH=-lgc(H+)计算pH;(3)H2S溶液中存在电离平衡H2S![]() H++HS-,加NaOH固体减小了溶液中H+浓度,该电离平衡向右移动,c(H+)减小;加NaHS固体时增大了HS-浓度,H2S
H++HS-,加NaOH固体减小了溶液中H+浓度,该电离平衡向右移动,c(H+)减小;加NaHS固体时增大了HS-浓度,H2S![]() H++HS-电离平衡左移,但溶液中c(HS-)增大,HS-
H++HS-电离平衡左移,但溶液中c(HS-)增大,HS-![]() H++S2-电离平衡右移,故c(S2-)增大。(4)盐酸和醋酸分别与锌反应的实质都是H+与Zn反应,随着H+的被消耗,在醋酸中电离平衡向右移动,在盐酸中不存在电离平衡由此分析。
H++S2-电离平衡右移,故c(S2-)增大。(4)盐酸和醋酸分别与锌反应的实质都是H+与Zn反应,随着H+的被消耗,在醋酸中电离平衡向右移动,在盐酸中不存在电离平衡由此分析。
(1)纯碱的化学成分是Na2CO3,属于强碱弱酸盐,其水解使溶液显碱性,滴入酚酞溶液呈红色,Na2CO3在水溶液中发生水解反应的离子方程式为:CO32-+H2O![]() HCO3-+OH-。
HCO3-+OH-。
(2)pH=2的盐酸中c(H+)=10-2mol/L,因盐酸是强酸完全电离,稀释过程中盐酸电离的H+物质的量不变,所以稀释后溶液中c(H+)=![]() =10-4mol/L,则稀释后pH=-lgc(H+)=-lg10-4=4。
=10-4mol/L,则稀释后pH=-lgc(H+)=-lg10-4=4。
(3)已知H2S溶液中存在电离平衡:H2S![]() H++HS-,加入NaOH固体时发生反应H++OH-=H2O,溶液中H+浓度减小,根据勒夏特列原理,该电离平衡向右移动,因中和反应是完全的,故最后溶液中c(H+)减小。向H2S溶液中加入NaHS固体时,NaHS溶于水发生完全电离NaHS=Na++HS-,增大了溶液中HS-浓度,根据勒夏特列原理,H2S
H++HS-,加入NaOH固体时发生反应H++OH-=H2O,溶液中H+浓度减小,根据勒夏特列原理,该电离平衡向右移动,因中和反应是完全的,故最后溶液中c(H+)减小。向H2S溶液中加入NaHS固体时,NaHS溶于水发生完全电离NaHS=Na++HS-,增大了溶液中HS-浓度,根据勒夏特列原理,H2S![]() H++HS-电离平衡向左移动。又因为溶液中HS-浓度增大,HS-
H++HS-电离平衡向左移动。又因为溶液中HS-浓度增大,HS-![]() H++S2-平衡向右移动,故最后溶液中c(S2-)增大。
H++S2-平衡向右移动,故最后溶液中c(S2-)增大。
(4)盐酸和醋酸分别与锌反应的实质都是H+与Zn的反应,而醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,盐酸中HCl完全电离,随着H+反应消耗,醋酸的电离平衡向右移动,所以醋酸中H+浓度减小的速度比盐酸中H+浓度减小的速度慢,即醋酸溶液中pH增大的速率比盐酸中pH增大的速率慢,所以B曲线是醋酸溶液pH变化曲线。由图像知盐酸和醋酸分别与锌反应过程的pH都是由2增大到4,即H+浓度都是由10-2mol/L减小到10-4mol/L,又因盐酸与醋酸溶液体积相同,因此盐酸和醋酸开始时H+物质的量相等,反应结束时盐酸和醋酸溶液中H+的物质的量也相等,假定消耗的Zn质量相同,则盐酸与醋酸中反应消耗H+的物质的量相同,但醋酸的电离平衡要向右移动,反应结束时醋酸中H+物质的量比盐酸多,若要使盐酸与醋酸反应结束时H+物质的量相等,只有在醋酸中再加适量的锌以消耗掉比盐酸多出的H+,所以醋酸溶液中加入的锌多,即m1<m2。
CH3COO-+H+,盐酸中HCl完全电离,随着H+反应消耗,醋酸的电离平衡向右移动,所以醋酸中H+浓度减小的速度比盐酸中H+浓度减小的速度慢,即醋酸溶液中pH增大的速率比盐酸中pH增大的速率慢,所以B曲线是醋酸溶液pH变化曲线。由图像知盐酸和醋酸分别与锌反应过程的pH都是由2增大到4,即H+浓度都是由10-2mol/L减小到10-4mol/L,又因盐酸与醋酸溶液体积相同,因此盐酸和醋酸开始时H+物质的量相等,反应结束时盐酸和醋酸溶液中H+的物质的量也相等,假定消耗的Zn质量相同,则盐酸与醋酸中反应消耗H+的物质的量相同,但醋酸的电离平衡要向右移动,反应结束时醋酸中H+物质的量比盐酸多,若要使盐酸与醋酸反应结束时H+物质的量相等,只有在醋酸中再加适量的锌以消耗掉比盐酸多出的H+,所以醋酸溶液中加入的锌多,即m1<m2。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下列实验描述、对应的现象以及结论都正确的是( )
选项 | 实验 | 现象 | 结论 |
A | 向滴有酚酞的Na2CO3溶液中加入BaCl2固体 | 溶液红色变浅 | Na2CO3溶液中存在水解平衡 |
B | 处理锅炉水垢中的CaSO4 时,依 次加入饱和Na2CO3溶液和盐酸 | 水垢溶解 | Ksp:CaCO3>CaSO4 |
C | 其它条件不变,平衡体系: FeCl3(aq)+3KSCN(aq) +3KCl(aq)中,加KCl 固体 | 红色变浅 | 证明增大生成物KCl的浓度,使原溶液中化学平衡逆向移动 |
D | 向浓度均为0.1 mol·L-1的NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 先出现 黄色沉淀 | Ksp:AgCl<AgI |
A. A B. B C. C D. D
【题目】按图装置进行实验,下列现象能推断出结论的是( )
选项 | 试剂X | Y中试剂及现象 | 结论 | 装置 |
A | 一种盐 | 酚酞溶液未变红 | 该盐不可能是铵盐 |
|
B | 小苏打和纯碱 | 石灰水变浑浊 | 纯碱比小苏打稳定 | |
C | 氢氧化钙与氯化铵 | 硝酸银溶液中先产生沉淀后溶解 | Ag2O能溶于氨水 | |
D | 氯酸钾与二氧化锰 | 淀粉、碘化钾和和硫酸的混合溶液变蓝 | 反应产生了Cl2 |
A. A B. B C. C D. D