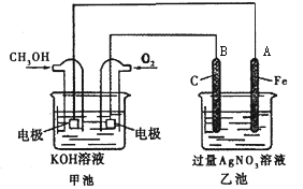
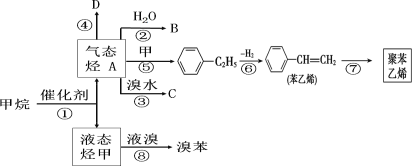
题目内容
【题目】短周期主族元素及其化合物在生产生活中至关重要。
(1)BF3与一定量水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:

晶体Q中含有的化学键包括____________________。
(2) NF3与NH3的空间构型相同,但NF3不易与Cu2+等形成配位键,其原因是___________。
(3)PCl5是一种白色晶体,在恒容密闭容器中加热可在148 ℃液化,形成一种能导电的熔体,测得其中含有阴阳离子各一种,结构是正四面体型离子和正八面体型离子;正八面体型离子的化学式为_________________________;正四面体型离子中键角大于PCl3的键角原因为______________________________________________________。
(4)氯化钠的晶胞结构如图所示,图是氯化钠的晶胞截面图(图中球大小代表半径大小)。已知NA代表阿伏加德罗常数的值,氯化钠晶体的密度为d g·cm-3。则Na+半径为____________pm(只需列出计算式)。

(5)砷化硼为立方晶系晶体,该晶胞中原子的分数坐标为:
B: (0,0,0); (![]() ,
,![]() ,0);(
,0);(![]() ,0,
,0,![]() );(0,
);(0,![]() ,
,![]() );……
);……
As:(![]() ,
,![]() ,
,![]() );(
);(![]() ,
,![]() ,
,![]() );(
);(![]() ,
,![]() ,
,![]() );(
);(![]() ,
,![]() ,
,![]() );……
);……
①请在图中画出砷化硼晶胞的俯视图______。
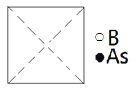
②砷原子紧邻的硼原子有________个,与每个硼原子紧邻的硼原子有______个。
【答案】共价键、配位 F的电负性比N大,NF成键电子对向F偏移,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子 PCl6— 两者磷原子均采取sp3杂化,PCl3分子中P原子有一对孤电子对,孤电子和对成键电子对斥力更大,PCl4+中P没有孤电子对,正四面体形阳离子中键角大于PCl3的键角 
 4 12
4 12
【解析】
(1)①根据Q的结构分析判断;
(2)Cu2+提供空轨道,NH3和NF3中的中心原子N原子提供孤电子对,根据NH3和NF3中共用电子对的偏转判断;
(3)PCl5是一种白色晶体,在恒容密闭容器中加热可在148℃液化,形成一种能导电的熔体,说明生成自由移动的阴阳离子,根据正四面体形阳离子和正六面体形阴离子分析判断;结合孤电子对对成键电子的排斥力大于成键电子对间的排斥力,判断PCl3与正四面体形阳离子中键角的大小;
(4)晶胞棱长=2×(Cl-离子半径+Na+离子半径),而晶胞棱长=2![]() ×Cl-离子半径,结合晶胞中各原子数目计算晶胞质量,结合密度计算晶胞体积,再计算晶胞棱长;
×Cl-离子半径,结合晶胞中各原子数目计算晶胞质量,结合密度计算晶胞体积,再计算晶胞棱长;
(5)①砷化硼为立方晶系晶体,根据晶胞中原子的分数坐标画出砷化硼的晶胞结构图,再画出砷化硼晶胞的俯视图;②根据①中画出的砷化硼的晶胞结构图分析判断。
(1)由Q的结构( )可知,Q分子中存在氢键、共价键、配位键(O与B之间)、分子间作用力,其中属于化学键的有共价键、配位键,故答案为:共价键、配位键;
)可知,Q分子中存在氢键、共价键、配位键(O与B之间)、分子间作用力,其中属于化学键的有共价键、配位键,故答案为:共价键、配位键;
(2)在形成的配合物中,Cu2+提供空轨道,NH3和NF3中的中心原子N原子提供孤电子对,由于N、F、H三种元素的电负性为F>N>H,在NF3中,共用电子对偏向F,偏离N原子,使得氮原子上的孤电子对难于与Cu2+形成配位键,故答案为:F的电负性比N大,NF成键电子对向F偏移,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子;
(3)PCl5是一种白色晶体,在恒容密闭容器中加热可在148℃液化,形成一种能导电的熔体,说明生成自由移动的阴阳离子,一种正四面体形阳离子是PCl4+和一种正八面体形阴离子是PCl6-,即发生反应为:2PCl5=PCl4++PCl6-;PCl3中价层电子对个数=σ键个数+孤电子对个数=3+![]() =4,所以原子杂化方式是sp3,PCl4+中价层电子对个数=σ键个数+孤电子对个数=4+
=4,所以原子杂化方式是sp3,PCl4+中价层电子对个数=σ键个数+孤电子对个数=4+![]() =4,所以原子杂化方式是sp3,PCl3分子中P原子有一对孤电子对,PCl4+中P没有孤电子对,孤电子对对成键电子的排斥力大于成键电子对间的排斥力,所以PCl4+中键角大于于PCl3的键角,故答案为:PCl6-;两者磷原子均采取sp3杂化,PCl3分子中P原子有一对孤电子对,孤电子和对成键电子对斥力更大,PCl4+中P没有孤电子对,正四面体形阳离子中键角大于PCl3的键角;
=4,所以原子杂化方式是sp3,PCl3分子中P原子有一对孤电子对,PCl4+中P没有孤电子对,孤电子对对成键电子的排斥力大于成键电子对间的排斥力,所以PCl4+中键角大于于PCl3的键角,故答案为:PCl6-;两者磷原子均采取sp3杂化,PCl3分子中P原子有一对孤电子对,孤电子和对成键电子对斥力更大,PCl4+中P没有孤电子对,正四面体形阳离子中键角大于PCl3的键角;
(4)晶胞棱长=2×(Cl-离子半径+Na+离子半径),而晶胞棱长=2![]() ×Cl -离子半径,晶胞质量=
×Cl -离子半径,晶胞质量=![]() g,晶胞体积=
g,晶胞体积= =
=![]() cm3,故晶胞棱长=
cm3,故晶胞棱长=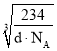 cm,则Cl -离子半径=
cm,则Cl -离子半径=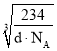 cm÷2
cm÷2![]() =
=![]() ×
×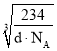 cm,Na+离子半径=
cm,Na+离子半径=![]() ×
×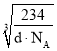 cm-
cm-![]() ×
×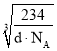 cm=
cm= cm=
cm=  pm,故答案为:
pm,故答案为: ;
;
(5)①砷化硼为立方晶系晶体,该晶胞中原子的分数坐标为:B: (0,0,0); (![]() ,
,![]() ,0);(
,0);(![]() ,0,
,0,![]() );(0,
);(0,![]() ,
,![]() );……;As:(
);……;As:(![]() ,
,![]() ,
,![]() );(
);(![]() ,
,![]() ,
,![]() );(
);(![]() ,
,![]() ,
,![]() );(
);(![]() ,
,![]() ,
,![]() );……;则砷化硼的晶胞结构图为
);……;则砷化硼的晶胞结构图为 ,因此砷化硼晶胞的俯视图为
,因此砷化硼晶胞的俯视图为 ,故答案为:
,故答案为: ;
;
②As与周围紧邻的4个B原子形成正四面体;以顶点B原子研究,与之紧邻的硼原子处于面心,每个顶点为8个晶胞共用,与每个硼原子紧邻的硼原子数目为![]() =12,故答案为:4;12。
=12,故答案为:4;12。