��Ŀ����
����Ŀ����ѧ�Ҷ�һ̼��ѧ�����˹㷺������о���ȡ����һЩ��Ҫ�ɹ���
��1����֪��CO(g)+2H2(g)![]() CH3OH(g) ��H1=-90.1kJ��mol-1��
CH3OH(g) ��H1=-90.1kJ��mol-1��
3CH3OH(g)![]() CH3CH=CH2(g)+3H2O(g) ��H2=-31.0 kJ��mol-1��
CH3CH=CH2(g)+3H2O(g) ��H2=-31.0 kJ��mol-1��
CO��H2�ϳ�CH3CH=CH2���Ȼ�ѧ����ʽΪ______________________________________��
��2���������������Ϊ2L�ĺ����ܱ��������������ֱ����1molCO��2molH2��������Ӧ��CO(g)+2H2(g)![]() CH3OH(g) ��H=-90.1kJ��mol-1�����������ķ�Ӧ�¶ȷֱ�ΪT1��T2��T3�Һ㶨���䡣����Ӧ�����е�5minʱH2�����������ͼ1��ʾ������ֻ��һ�������еķ�Ӧ�Ѿ��ﵽƽ��״̬��
CH3OH(g) ��H=-90.1kJ��mol-1�����������ķ�Ӧ�¶ȷֱ�ΪT1��T2��T3�Һ㶨���䡣����Ӧ�����е�5minʱH2�����������ͼ1��ʾ������ֻ��һ�������еķ�Ӧ�Ѿ��ﵽƽ��״̬��
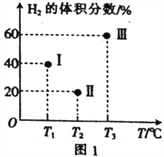
��5minʱ���������еķ�Ӧ�ﵽ��ѧƽ��״̬��������_____________�����������
��0~5min������������CH3OH��ʾ�Ļ�ѧ��Ӧ����v(CH3OH)=_________________��
�������������еķ�Ӧ���ﵽƽ��״̬ʱ��CO��ת������ߵ�������____________�����������ͬ����ƽ�ⳣ����С��������____________________��
��3��CO�����ڹ�ҵұ���������ڲ�ͬ�¶�����CO��ԭ���ֽ������������ﵽƽ���������lg![]() ���¶���T���Ĺ�ϵ��ͼ2��ʾ������˵����ȷ����_____________������ĸ����
���¶���T���Ĺ�ϵ��ͼ2��ʾ������˵����ȷ����_____________������ĸ����
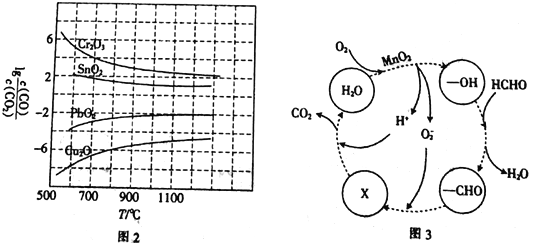
a.��ҵ�Ͽ���ͨ�����߷�Ӧװ�����ӳ���ʯ��CO�Ӵ���ʱ�䣬����β����CO�ĺ���
b.CO���ڹ�ҵұ��������(Cr)ʱ����ԭЧ�ʲ���
c.��ҵұ������ͭ(Cu)ʱ��600����CO�������ʱ�100����CO�������ʸ���
d.CO��ԭPbO2��Ӧ����H>0
���𰸡� 3CO(g)+6H2(g)![]() CH3CH=CH2(g)+3H2O(g) ��H=-301.3kJ��mol-1 �� 0.067mol��L-1��min-1(��
CH3CH=CH2(g)+3H2O(g) ��H=-301.3kJ��mol-1 �� 0.067mol��L-1��min-1(��![]() mol��L-1��min-1) �� �� bc
mol��L-1��min-1) �� �� bc
����������1�����⿼���Ȼ�ѧ��Ӧ����ʽ�ļ��㣬��CO(g)+2H2(g)![]() CH3OH(g) ����3CH3OH(g)
CH3OH(g) ����3CH3OH(g)![]() CH3CH=CH2(g)+3H2O(g) ���١�3���ڣ��ó���3CO(g)+6H2(g) CH3CH=CH2(g)+3H2O(g) ��H=��301.3kJ��mol��1����2�����⿼�黯ѧƽ��״̬���жϡ���������ԭ������ѧƽ�ⳣ������I��II���������������С��˵����Ӧ������Ӧ������У�û�дﵽ��ѧƽ�⣬��III�����������������˵�������¶ȣ�ƽ�����淴Ӧ������У�III�ﵽƽ�⣻��
CH3CH=CH2(g)+3H2O(g) ���١�3���ڣ��ó���3CO(g)+6H2(g) CH3CH=CH2(g)+3H2O(g) ��H=��301.3kJ��mol��1����2�����⿼�黯ѧƽ��״̬���жϡ���������ԭ������ѧƽ�ⳣ������I��II���������������С��˵����Ӧ������Ӧ������У�û�дﵽ��ѧƽ�⣬��III�����������������˵�������¶ȣ�ƽ�����淴Ӧ������У�III�ﵽƽ�⣻��
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
��ʼ�� 1 2 0
�仯�� x 2x x
5min��1��x 2��2x x I�����е��������������Ϊ40%�������(2��2x)/(3��2x)��100%=40%����x=2/3mol�����ݻ�ѧ��Ӧ���ʵ���ѧ����ʽ��v(CH3OH)=2/(3��5��2)mol/(L��min)=1/15mol/(L��min)���۴˷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ�����COת������ߵ�������I��ƽ�ⳣ��ֻ���¶ȵ�Ӱ�죬�¶����ߣ�ƽ�����淴Ӧ������У���ѧƽ�ⳣ����С����˻�ѧƽ�ⳣ����С����III����3�����⿼�黯ѧͼ��a�����ߣ��ӳ���ʯ��CO�Ӵ���ʱ�䣬�Ի�ѧƽ���ƶ���Ӱ�죬CO�������ʲ��ͣ���a����b����ͼ���֪��CO��ҵұ��������ʱ��lg![]() һֱ�ܸߣ�˵��COת���ʺܵͣ���b��ȷ��c����ͼ���֪���¶�Խ�ͣ�lg
һֱ�ܸߣ�˵��COת���ʺܵͣ���b��ȷ��c����ͼ���֪���¶�Խ�ͣ�lg![]() ԽС��COת����Խ�ߣ���c��ȷ��d����ͼ���֪CO��ԭPbO2���¶�Խ��lg
ԽС��COת����Խ�ߣ���c��ȷ��d����ͼ���֪CO��ԭPbO2���¶�Խ��lg![]() Խ�ߣ�˵��COת����Խ�ͣ�ƽ�������ƶ�����H<0����d����
Խ�ߣ�˵��COת����Խ�ͣ�ƽ�������ƶ�����H<0����d����

 ����ͼ����ּ��������ҵ֣�ݴ�ѧ������ϵ�д�
����ͼ����ּ��������ҵ֣�ݴ�ѧ������ϵ�д�����Ŀ���״���һ����Ҫ�Ļ���ԭ�ϣ�����һ�ֿ�������Դ�����п�����Ӧ�õĹ���ǰ����
(1)��֪��CH3OH(g)===HCHO(g)��H2(g) ��H����84 kJ��mol��1
2H2(g)��O2(g)===2H2O(g) ��H����484 kJ��mol��1
�ٹ�ҵ�ϳ��Լ״�Ϊԭ����ȡ��ȩ����д��CH3OH(g)��O2(g)��Ӧ����HCHO(g)��H2O(g)���Ȼ�ѧ����ʽ��______________________________________________��
���������Ʊ���ȩʱ������Ӧ����ͨ���ʵ���������������Ŀ��_________________��
(2)��ҵ�Ͽ������·����ϳɼ״�����ѧ����ʽΪCO(g)��2H2(g)==CH3OH(g)����֪ijЩ��ѧ���ļ����������±���
��ѧ�� | C��C | C��H | H��H | C��O | C��O | O��H |
����/(kJ��mol��1) | 348 | 413 | 436 | 358 | x | 463 |
��ش��������⣺
��ͼ1������a������b�Ĵ�ʩ��_________��

����֪CO�е�C��O֮��Ϊ�����������Ϊx kJ/mol����x��________��
(3)�ɼ״���������NaOH��Һ���ɵ������ֻ���أ���ʹ�ֻ�����ʹ��һ���²ų�һ�ε硣
�ٸõ�ظ����ĵ缫��ӦʽΪ______________________________________��
�����Ըõ��Ϊ��Դ����ʯī���缫���200 mL�����������ӵ���Һ��
���� | Cu2�� | H�� | Cl�� | SO42�� |
c/(mol��L��1) | 0.5 | 2 | 2 | 0.5 |
���һ��ʱ��������ռ�����ͬ���(��ͬ������)������ʱ(������Һ����ı仯���缫������ܴ��ڵ��ܽ�����)�������ռ�������������Ϊ________��
(4)���ˮ������CO2�����ϳ���(H2
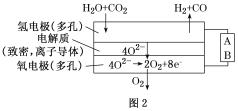
����Ŀ����������ʵ���˵������ȷ���ǣ�
���� | ���� |
| ��ͭƬ�ܽ⣬��Һ��������ʼ��������ɫ���壬������ɫ�䵭��ֱ����ɫ���ڹܿڴ���Ϊ����ɫ ��ͭƬ�����ܽ⣬������ɫ���壬�ڹܿڴ���Ϊ����ɫ |
A. ʵ���в�������ɫ���壬˵��ŨHNO3����������
B. ������ʵ������У������ķ�Ӧ����2��
C. ���в�����ɫ���壬˵��������������
D. ����ͭƬ������Ƭ�������û������ʵ������
����Ŀ��Ϊ̽��Ӱ�컯ѧ��Ӧ���ʵ����أ���25mL 5%��H2O2��Һ�У���������������������������ʱ��������ʱ����̵��ǣ�
��� | V(1mol/L FeCl3)/mL | ����ˮ/mL | �¶�/�� |
A | 2 | 2 | 50 |
B | 3 | 1 | 40 |
C | 2 | 2 | 40 |
D | 3 | 1 | 50 |
A.AB.BC.CD.D

