题目内容
14.下列事实中,能说明氯的非金属性比溴强的是( )| A. | HCl的酸性比HBr强 | |
| B. | 次氯酸的氧化性比次溴酸强 | |
| C. | 氯化氢比溴化氢的热稳定性好 | |
| D. | 氯原子最外层电子数比溴原子最外层电子数多 |
分析 元素的非金属性越强,其最高价氧化物的水化物酸性越强、其单质的氧化性越强、其氢化物的稳定性越强等,据此分析解答.
解答 解:A.HCl的酸性比HBr强,说明HCl的电离程度大于HBr,不能说明非金属性Cl比Br强,故A错误;
B.次氯酸的氧化性比次溴酸强,不是其最高价氧化物的水化物酸性强弱比较,所以不能比较其非金属性强弱,故B错误;
C.氯化氢比溴化氢的热稳定性好,说明溴离子还原性比氯离子强,则非金属性Cl>Br,故C正确;
D.Cl、Br属于同一主族元素,其最外层电子数相等,故D错误;
故选C.
点评 本题考查非金属强弱判断,侧重考查学生知识运用能力及分析判断能力,明确元素非金属性强弱与得电子多少无关,与得电子难易程度有关,易错选项是B.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
4. 全电动汽车使用的是钴酸锂电池,其工作原理如图,A极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2.则有关说法不正确的是( )
全电动汽车使用的是钴酸锂电池,其工作原理如图,A极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2.则有关说法不正确的是( )
 全电动汽车使用的是钴酸锂电池,其工作原理如图,A极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2.则有关说法不正确的是( )
全电动汽车使用的是钴酸锂电池,其工作原理如图,A极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2.则有关说法不正确的是( )| A. | 放电时电子从A极通过导线流向B极有关 | |
| B. | 放电时A是负极,电极反应式为:LixC6-xe-=C6+xLi+ | |
| C. | 充电时Li+从左边流向右边 | |
| D. | 充电时B作阳极,电极反应式为:LiCoO2-xe-=Li1-xCoO2+xLi+ |
2.乙烯保鲜膜按材质可分为聚乙烯(PE)、聚氯乙烯(PVC)等.工业上以乙烯和氯气为主要原料来合成PE和PVC的流程如下所示.下列说法正确的是( )
PE$\stackrel{①}{←}$乙烯$\stackrel{②}{→}$A$\stackrel{③}{→}$B $\stackrel{④}{→}$PVC.
PE$\stackrel{①}{←}$乙烯$\stackrel{②}{→}$A$\stackrel{③}{→}$B $\stackrel{④}{→}$PVC.
| A. | PE和PVC制成的保鲜膜均有毒,不能用于保鲜食品 | |
| B. | 乙烯、聚乙烯和聚氯乙烯均能与溴水发生加成反应,使之褪色 | |
| C. | 上述流程中A是ClCH2CH2Cl,B是CH2═CHCl | |
| D. | ①②③④四步反应中,无消去反应 |
9.分类是化学学习和研究中的常用手段,下列分类依据和结论都正确的是( )
| A. | 浓盐酸、浓硫酸、浓硝酸均具有氧化性,都属于氧化性酸 | |
| B. | Na2O、SO2、BaSO4在熔融状态或溶于水时均能导电,都属于电解质 | |
| C. | NaOH、HNO3、NaNO3在水溶液中均能电离出离子,都属于离子化合物 | |
| D. | 金刚石、二氧化硅、碳化硅晶体中原子间均以共价键结合,都属于原子晶体 |
19.盐的水解程度大小可以用“水解度”来表示.关于NaA(A-表示一元酸根离子)型盐的水解度,就是已水解的盐的物质的量占原来盐总物质的量的百分数.若测得25℃时2L 0.1mol•L-1的强碱弱酸盐NaA溶液pH值为10,则A-的水解度是( )
| A. | 0.01% | B. | 0.1% | C. | 0.2% | D. | 1% |
6.同族元素所形成的同一类型的化合物,其结构和性质往往相似.化合物PH4I是一种白色晶体,下列对它的描述中正确的是( )
| A. | 它是一种共价化合物 | |
| B. | 在加热时此化合物可以分解为PH3和HI | |
| C. | 这种化合物不能跟碱反应 | |
| D. | 该化合物中只含有共价键 |
3.把金属钠和金属钠在空气中的燃烧产物P分别加入到足量的水中,生成的气体在一定条件下恰好完全反应,则与水反应的金属钠与被氧化成P的金属钠的质量比为( )
| A. | 23:78 | B. | 2:1 | C. | 1:1 | D. | 46:78 |
4.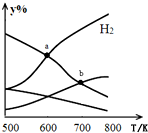 以二氧化碳和氢气为原料制取乙醇的反应为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3CH2OH(g)+3H2O(g)△H<0某压强下的密闭容器中,按CO2和H2的物质的量比为1:3投料,不同温度下平衡体系中各物质的物质的量百分数(y%)随温度变化如图所示.下列说法正确的是( )
以二氧化碳和氢气为原料制取乙醇的反应为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3CH2OH(g)+3H2O(g)△H<0某压强下的密闭容器中,按CO2和H2的物质的量比为1:3投料,不同温度下平衡体系中各物质的物质的量百分数(y%)随温度变化如图所示.下列说法正确的是( )
 以二氧化碳和氢气为原料制取乙醇的反应为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3CH2OH(g)+3H2O(g)△H<0某压强下的密闭容器中,按CO2和H2的物质的量比为1:3投料,不同温度下平衡体系中各物质的物质的量百分数(y%)随温度变化如图所示.下列说法正确的是( )
以二氧化碳和氢气为原料制取乙醇的反应为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3CH2OH(g)+3H2O(g)△H<0某压强下的密闭容器中,按CO2和H2的物质的量比为1:3投料,不同温度下平衡体系中各物质的物质的量百分数(y%)随温度变化如图所示.下列说法正确的是( )| A. | a点的平衡常数小于b点 | |
| B. | b点,v正(CO2)=v逆(H2O) | |
| C. | a点,H2和H2O物质的量相等 | |
| D. | 其他条件恒定,充入更多H2,v(CO2)不变 |