题目内容
8.将一表面已经被氧化的金属钠0.54g投入水中,充分反应后,生成的溶液需用0.5ml•L-1硫酸溶液20mL才能恰好中和.求该金属钠中钠的质量分数.分析 氢氧化钠和硫酸之间发生中和反应生成硫酸钠和水,根据硫酸钠中n(Na+)=2n(SO42-),0.5ml•L-1硫酸溶液20mL中n(SO42-)=0.1mol,所以n(Na+)=0.2mol,根据钠元素守恒计算金属钠的质量,进而计算钠的质量分数.
解答 解:氢氧化钠和硫酸之间发生中和反应生成硫酸钠和水,根据硫酸钠中n(Na+)=2n(SO42-),0.5ml•L-1硫酸溶液20mL中n(SO42-)=0.01mol,所以n(Na+)=0.02mol,设:金属钠的物质的量是x,氧化钠的物质的量是y,根据钠元素守恒:x+2y=0.02;23x+62y=0.54,解得x=0.01mol,y=0.005mol,该金属钠中钠的质量分数为$\frac{0.01×23}{0.54}$×100%=42.6%,
答:该金属钠中钠的质量分数是42.6%.
点评 本题考查学生金属钠的性质以及质量分数的计算知识,注意元素守恒知识的应用是关键.

练习册系列答案
 全程金卷系列答案
全程金卷系列答案
相关题目
18.化学与人类生产、生活密切相关,下列说法正确的是( )
| A. | 氮的固定是指将气态氮气变为固态 | |
| B. | Na2SiO3水溶液俗称水玻璃,是制备硅胶和木材防火剂的原料 | |
| C. | 金属可分为“黑色金属”和“有色金属”,铁及其合金都属于“有色金属” | |
| D. | 包装食品里常有硅胶、石灰、还原铁粉三类小包,其作用相同 |
13.进行过滤操作应选用的一组仪器是( )
| A. | 烧杯、试管夹、漏斗、玻璃棒 | B. | 烧杯、酒精灯、试管、漏斗 | ||
| C. | 漏斗、玻璃棒、烧杯、铁架台 | D. | 玻璃棒、烧杯、漏斗、蒸发皿 |
20.取ag某物质放在盛有足量过氧化钠固体的容器中,然后通入足量02,用电火花不断引燃使其充分反应,最后称得固体的质量增加小于ag,则该物质是( )
| A. | 甘油[HOCH2-CH(OH)-CH2OH] | B. | 烃基乙酸[OHCH2COOH] | ||
| C. | 葡萄糖(C6H12O6) | D. | 蔗糖(C12H22O11) |
7.将2.7g铝溶解于100mL3mol/LNaOH溶液中,然后向所得溶液中加入400mL,1mol/L的盐酸,最后可得沉淀的质量是( )
| A. | 2.7g | B. | 5.2g | C. | 7.8g | D. | 10g |
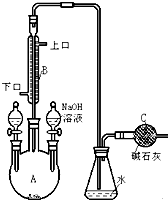 制备溴苯的实验装置如图所示,回答下列问题:
制备溴苯的实验装置如图所示,回答下列问题: