题目内容
20.取ag某物质放在盛有足量过氧化钠固体的容器中,然后通入足量02,用电火花不断引燃使其充分反应,最后称得固体的质量增加小于ag,则该物质是( )| A. | 甘油[HOCH2-CH(OH)-CH2OH] | B. | 烃基乙酸[OHCH2COOH] | ||
| C. | 葡萄糖(C6H12O6) | D. | 蔗糖(C12H22O11) |
分析 各物质充分燃烧后生成CO2、H2O,再通过足量的Na2O2,发生反应:2CO2+2Na2O2=2Na2CO3+O2,过氧化钠增重等于与CO2同物质的量的CO的质量,发生反应:2H2O+2Na2O2=4NaOH+O2,过氧化钠增重等于与H2O同物质的量的H2质量,即化学式可以改写成(CO)n•(H2)m,完全燃烧后过氧化钠增重等于ag,据此结合选项解答.
解答 解:各物质充分燃烧后生成CO2、H2O,再通过足量的Na2O2,发生反应:2CO2+2Na2O2=2Na2CO3+O2,过氧化钠增重等于与CO2同物质的量的CO的质量,发生反应:2H2O+2Na2O2=4NaOH+O2,过氧化钠增重等于与H2O同物质的量的H2质量,即化学式可以改写成(CO)n•(H2)m,完全燃烧后过氧化钠增重等于ag,
A.甘油[HOCH2-CH(OH)-CH2OH]可以改写为(CO)3•(H2)4,完全燃烧后过氧化钠增重等于ag,不符合题意,故A错误;
B.烃基乙酸[OHCH2COOH],改写为(CO)•(H2)m•(CO2),完全燃烧后过氧化钠增重小于ag,符合题意,故B正确;
C.葡萄糖(C6H12O6)可以改写为(CO)6•(H2)6,完全燃烧后过氧化钠增重等于ag,不符合题意,故C错误;
D.蔗糖(C12H22O11)改写成(CO)11•(H2)11•C,完全燃烧后过氧化钠增重大于ag,不符合题意,故D错误.
故选:B.
点评 本题考查方程式计算、钠的重要化合物性质等,关键是根据方程式得出固体增加的质量相当于CO和H2的质量,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.一定温度下,wg下列物质在足量氧气中充分燃烧,产物与过量的过氧化钠完全反应,过氧化钠固体增重wg,符合此要求的是( )
①H2 ②CO ③CO和H2 ④HCOOCH3 ⑤HOOC-COOH ⑥C6H12O6 ⑦C12H22O11.
①H2 ②CO ③CO和H2 ④HCOOCH3 ⑤HOOC-COOH ⑥C6H12O6 ⑦C12H22O11.
| A. | 全部 | B. | 仅④⑤ | C. | 仅①②③ | D. | 除⑤⑦外 |
11.单质X和单质Y能发生下列化学反应,每一个反应只有两种元素的化合价发生了变化:
①X+H2O→W+H2
②Y+H2O→N+O2
下列说法正确的是( )
①X+H2O→W+H2
②Y+H2O→N+O2
下列说法正确的是( )
| A. | X一定是非金属单质 | B. | X一定是金属单质 | ||
| C. | Y一定是非金属单质 | D. | Y一定是金属单质 |
18.二氧化锰是一次电池制造的基本材料.工业上以软锰矿为原料制备高纯二氧化锰的流程如下:
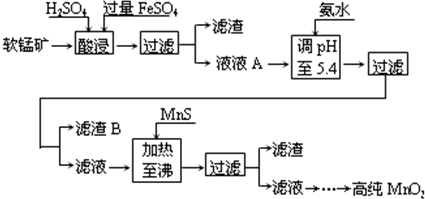
某软锰矿的主要成分为MnO2,还含有Si(16.72%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为2FeSO4+MnO2+2H2SO4=MnSO4+Fe2(SO4)3+2H2O.
(2)滤渣B的主要成分有Fe(OH)3和Al(OH)3.
(3)加入MnS的目的是除去Cu2+、Zn2+杂质.

某软锰矿的主要成分为MnO2,还含有Si(16.72%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
(2)滤渣B的主要成分有Fe(OH)3和Al(OH)3.
(3)加入MnS的目的是除去Cu2+、Zn2+杂质.
19.(1)CO与H2在一定条件下可反应生成甲醇:CO(g)+2H2(g)═CH3OH(g).甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨作电极,该电池负极反应式为CH3OH(g)+H2O-6e-=CO2+6H+.
(2)高铁酸钾(K2FeO4)易溶于水,具有强氧化性,是一种新型水处理剂,高铁酸钾溶液长时间放置不稳定,会产生红褐色絮状物质及一种助燃性的气体,则该过程的离子方程式为4FeO42-+10H2O=4Fe(OH)3+8OH-+3O2↑.
(3)已知:
工业制镁时,电解MgCl2而不电解MgO的原因是MgO的熔点比MgCl2的熔点高,MgO熔融时耗费更多能源,增加成本;制铝时,电解Al2O3而不电解AlCl3的原因是AlCl3是共价化合物,熔融态时不电离,难导电.
(4)为测定三草酸合铁酸钾晶体中草酸根的含量,通常将其配成溶液再用H2SO4酸化,滴加KMnO4溶液将草酸根恰好全部氧化成CO2,MnO4-同时被还原为Mn2+此反应不要(要/不要)外加指示剂,达到滴定终点的现象为当待测液中出现紫红色,且振荡后半分钟内不再褪色,就表明到了终点.
(2)高铁酸钾(K2FeO4)易溶于水,具有强氧化性,是一种新型水处理剂,高铁酸钾溶液长时间放置不稳定,会产生红褐色絮状物质及一种助燃性的气体,则该过程的离子方程式为4FeO42-+10H2O=4Fe(OH)3+8OH-+3O2↑.
(3)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
(4)为测定三草酸合铁酸钾晶体中草酸根的含量,通常将其配成溶液再用H2SO4酸化,滴加KMnO4溶液将草酸根恰好全部氧化成CO2,MnO4-同时被还原为Mn2+此反应不要(要/不要)外加指示剂,达到滴定终点的现象为当待测液中出现紫红色,且振荡后半分钟内不再褪色,就表明到了终点.
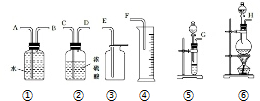 现有一定量的乙醚和乙醇的混合物试样.请从图中选用适当的实验装置,设计一个最简单的实验,测定试样中乙醇的含量.可供选用的反应物和试剂为:新制的生石灰、浓硫酸、蒸馏水、金属钠、碱石灰、无水硫酸铜.
现有一定量的乙醚和乙醇的混合物试样.请从图中选用适当的实验装置,设计一个最简单的实验,测定试样中乙醇的含量.可供选用的反应物和试剂为:新制的生石灰、浓硫酸、蒸馏水、金属钠、碱石灰、无水硫酸铜.
 .
.