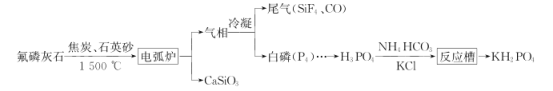
题目内容
【题目】某含镍(NiO)废料中有FeO、Al2O3、MgO、SiO2等杂质,用此废料提取NiSO4的工艺流程如图1所示:
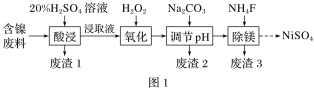
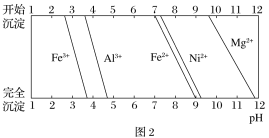
已知:①有关金属离子生成氢氧化物沉淀所需的pH如图2所示。
②25 ℃时,NH3·H2O的电离常数Kb=1.8×10-5。HF的电离常数Ka=7.2×10-4,Ksp(MgF2)=7.4×10-11。
(1)“酸浸”时,为提高浸出速率,可采取的措施有______________(写一条即可)。
(2)废渣1的主要成分是________(填化学式)。“氧化”步骤中加入H2O2的目的是____________(用离子方程式表示)。加Na2CO3调节溶液的pH至5,得到废渣2的主要成分是____________(填化学式)。
(3)25 ℃时,1 mol·L-1的NaF溶液中c(OH-)=____________(列出计算式即可) mol·L-1。NH4F溶液呈________(填“酸性”“碱性”或“中性”)。
(4)已知沉淀前溶液中c(Mg2+)=1.85×10-3mol·L-1,当除镁率达到99%时,溶液中c(F-)=________ mol·L-1。
【答案】增加硫酸浓度或提高反应温度(合理即可) SiO2 2Fe2++2H++H2O2==2Fe3++2H2O Fe(OH)3、Al(OH)3 ![]() 酸性 2.0×10-3
酸性 2.0×10-3
【解析】
含镍废料酸浸时,生成硫酸镍、硫酸亚铁、硫酸铝、硫酸镁溶液,和不溶物为二氧化硅,则滤渣1为二氧化硅;根据图2沉淀表,则需氧化亚铁离子为铁离子后调节pH逐个除去杂质离子,用氟离子除去溶液中的镁离子。
(1)为提高浸出速率,粉碎原材料或升高温度或增大酸的浓度均可;
(2)废料中只有二氧化硅不溶于硫酸,则废渣1为二氧化硅;除亚铁离子的pH为7~9,与镍离子接近,则需氧化为铁离子除去,加入过氧化钠的目的为氧化亚铁离子为铁离子,反应的离子方程式为2Fe2++2H++H2O2==2Fe3++2H2O;加Na2CO3调节溶液的pH至5,除去溶液中的铁离子、铝离子,生成氢氧化铁和氢氧化铝沉淀;
(3)1mol·L-1的NaF溶液中c(F-)=1mol/L,根据F-+H2OOH-+HF,c(OH-)=c(HF),c(OH-)×c(HF)=Kh×c(F-)=![]() ,则c(OH-)=
,则c(OH-)=![]() mol/L;已知25℃时,NH3·H2O的电离常数Kb=1.8×10-5。HF的电离常数Ka=7.2×10-4,NH4F相当于为强酸弱碱盐,溶液显酸性;
mol/L;已知25℃时,NH3·H2O的电离常数Kb=1.8×10-5。HF的电离常数Ka=7.2×10-4,NH4F相当于为强酸弱碱盐,溶液显酸性;
(4)当除镁率达到99%时,溶液中剩余c(Mg2+)=1.85×10-3×1%=1.85×10-5mol/L,c(Mg2+)×c2(F-)=Ksp(MgF2),则c2(F-)=![]() =4×10-6,c(F-)=2×10-3mol/L。
=4×10-6,c(F-)=2×10-3mol/L。

【题目】25 ℃时,有下列四种溶液:
① | ② | ③ | ④ |
0.1 mol·L-1氨水 | pH=11氨水 | 0.1 mol·L-1盐酸 | pH=3盐酸 |
下列说法中正确的是( )
A. ①稀释到原来的100倍后,pH与②相同
B. 等体积①③混合、等体积②④混合所得的溶液都呈酸性
C. ①②中分别加入少量CH3COONa固体,![]() 的值都变小
的值都变小
D. ③④稀释到原来的100倍后,稀释后④溶液中的pH大