题目内容
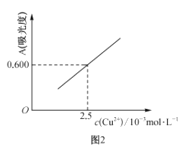
【题目】常温下,用0.1000mol·L-1的盐酸采用“双指示剂法"滴定25.00mL0.1000mol·L-1纯碱溶液,滴定曲线如图所示。下列说法正确的是( )
A.开始滴定到终点①过程应采用甲基橙作指示剂
B.由①到②的过程中会出现c(Na+)>2c(CO32-)+c (HCO3-)
C.滴定终点①处,水电离出的氢离子浓度约为10-8.7mol·L-1
D.滴定过程中含碳微粒的总浓度始终保持0.1000mol·L-1
【答案】B
【解析】
从开始滴定到终点①过程中发生反应Na2CO3+HCl=NaHCO3+NaCl,终点①为NaHCO3和NaCl的混合溶液,溶液显碱性,从终点①到终点②过程中发生反应NaHCO3+HCl=NaCl+H2O+CO2,终点②为NaCl溶液,据此解答。
A. 终点①为NaHCO3和NaCl的混合溶液,溶液显碱性,应使用酚酞作指示剂,A项错误;
B. 由①到②的过程中,有电荷守恒c(Na+)+c(H+)=2c(CO32-)+c (HCO3-)+c(Cl-)+c(OH-),又因为溶液显碱性,即c(H+)<c(OH-),则c(Na+)>2c(CO32-)+c (HCO3-),B项正确;
C. 滴定终点①处为NaHCO3和NaCl的混合溶液,HCO3-的水解程度大于其电离程度,则水的电离是被促进的,则水电离出氢离子的浓度应大于10-7mol·L-1,水电离出的氢离子浓度与溶液中氢氧根离子浓度相等,c(H+)=10-5.3mol·L-1,C项错误;
D. 滴定过程中溶液体积不断增大,根据元素守恒可知,含碳微粒的总浓度小于0.1000mol·L-1,D项错误;
故选B。

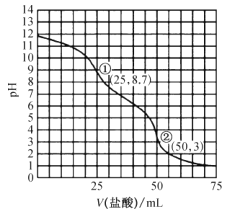
【题目】为探究新制氯水的性质,某学生做了如下实验。
实验 | 装置 | 试剂a | 现象 |
① |
| 紫色的石蕊试液 | 溶液先变红后褪色 |
② | NaHCO3溶液 | 产生气泡 | |
③ | HNO3酸化的AgNO3溶液 | 产生白色沉淀 | |
④ | FeCl2溶液、KSCN溶液 | 溶液变红 |
由上述实验可得新制氯水的性质与对应的解释或离子方程式不相符的是
A.实验①说明新制氯水中含有H+、HClO
B.实验②发生的反应为HCO3-+HClO=ClO-+CO2↑+H2O
C.实验③说明新制氯水中有Cl-,Cl-+Ag+=AgCl↓
D.实验④说明氯气具有强氧化性,Cl2+2Fe2+=2Cl-+2Fe3+