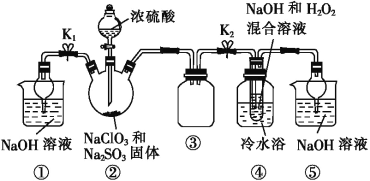
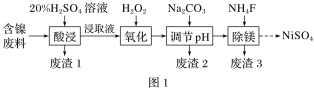
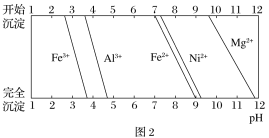
题目内容
【题目】用无水Na2CO3固体配制250mL 0.1000mol·L-1的溶液。请回答:
(1)在配制过程中用到的仪器是______(填序号)。
A.烧杯 B. 托盘天平 C.玻璃棒 D.胶头滴管 E.容量瓶
(2)需要无水Na2CO3的质量______克。
(3)定容时的操作:当液面接近容量瓶刻度线________cm时改用__________(胶头滴管、烧杯、试管)再将容量瓶塞盖好,反复上下颠倒,摇匀。
【答案】ABCDE 2.65 1-2 胶头滴管
【解析】
(1)用无水Na2CO3固体配制250mL 0.1000mol·L-1的溶液需要用到的仪器有:托盘天平、烧杯、玻璃棒、胶头滴管、250mL容量瓶,故答案为:ABCDE;
(2)溶液中溶质Na2CO3的物质的量![]() ,则需要无水Na2CO3的质量
,则需要无水Na2CO3的质量![]() ,故答案为:2.65;
,故答案为:2.65;
(3)定容时的操作:当液面接近容量瓶刻度线1-2cm时改用胶头滴管滴加直到凹型液面最低处与刻度相平,故答案为:1-2;胶头滴管。

 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案【题目】B. [实验化学]
乙酰苯胺具有退热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称。其制备原理如下:

已知:
①苯胺易被氧化;
②乙酰苯胺、苯胺和醋酸的部分物理性质如下表:
物质 | 熔点 | 沸点 | 溶解度(20 ℃) |
乙酰苯胺 | 114.3℃ | 305℃ | 0.46 |
苯胺 | -6℃ | 184.4℃ | 3.4 |
醋酸 | 16.6℃ | 118℃ | 易溶 |
实验步骤如下:
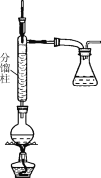
步骤1:在50 mL圆底烧瓶中,加入5 mL苯胺、7.5 mL冰醋酸及少许锌粉,依照如图装置组装仪器。
步骤2:控制温度计示数约105 ℃,小火加热回流1 h。
步骤3:趁热将反应混合物倒入盛有100 mL冷水的烧杯中,冷却后抽滤,洗涤,得到粗产品。
(1)步骤1中加入锌粉的作用是________。
(2)步骤2中控制温度计示数约105℃的原因是________。
(3)步骤3中趁热将混合物倒入盛有冷水的烧杯中,“趁热”的原因是__________________。抽滤装置所包含的仪器除减压系统外,还有________、________(填仪器名称)。
(4)步骤3得到的粗产品需进一步提纯,该提纯方法是________。