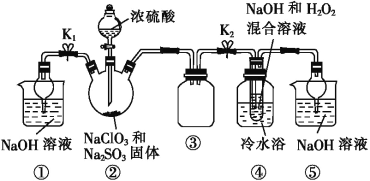
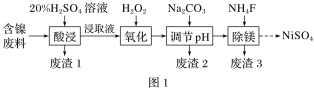
题目内容
【题目】磷灰石是一系列磷酸盐矿物的总称,主要指氟磷灰石[Ca5(PO4)3F],以氟磷灰石为原料可制备缓冲试剂磷酸二氢钾(KH2PO4),其工艺流程如图所示:
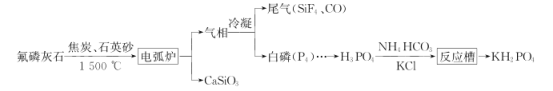
回答下列问题:
(1)电弧炉中发生反应的化学方程式:__。
(2)制得的白磷中常含有少量的砷,利用稀硝酸,可将砷转化为亚砷酸(H3AsO3)和砷酸(H3AsO4)而除去。使用质量分数为25%(密度为1.15g·cm-3)的硝酸效果最佳,此硝酸的质量摩尔浓度(单位质量的溶剂中所含溶质的物质的量)为__×10-3mol·g-1(保留一位小数),除砷过程中需要控制温度为75℃,且在高纯N2的保护下进行,温度不能过高的原因是__。
(3)反应槽中发生反应的离子方程式为__。
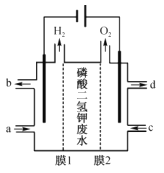
(4)通过如图电解系统可从磷酸二氢钾废水中提取磷酸和氢氧化钾。膜1为__(填“阳离子”或“阴离子”)交换膜,阳极电极反应式为__,转移0.15mol电子,理论上获得磷酸的质量为__g。
(5)自然界中Ca5(PO4)3OH与Ca5(PO4)3F存在如下平衡:Ca5(PO4)3OH(s)+F-(aq)![]() Ca5(PO4)3F(s)+OH-(aq),该反应的平衡常数K=__,{已知:Ksp[Ca5(PO4)3OH]=7.0×10-37,Ksp[Ca5(PO4)3F]=2.8×10-61}。
Ca5(PO4)3F(s)+OH-(aq),该反应的平衡常数K=__,{已知:Ksp[Ca5(PO4)3OH]=7.0×10-37,Ksp[Ca5(PO4)3F]=2.8×10-61}。
【答案】![]() 5.3 温度过高,硝酸会大量分解
5.3 温度过高,硝酸会大量分解 ![]() 1 阳离子
1 阳离子 ![]() 14.7 2.5×1024
14.7 2.5×1024
【解析】
(1)由流程图可知,电弧炉中发生的反应为Ca5(PO4)3F与焦炭、石英砂(主要成分为SiO2)在1500。C高温下反应生成CaSiO3、白磷、SiF4和CO,根据元素守恒、得失电子守恒配平该化学方程式;
(2)根据质量摩尔浓度的定义,取质量分数为25%的硝酸100g,则溶质硝酸的质量为25g,溶剂水的质量为75g,进行计算;硝酸不稳定,受热易分解;
(3)由流程图可知,反应槽中磷酸与碳酸氢根反应生成磷酸二氢根、水和二氧化碳;
(4)根据图示电解系统可从磷酸二氢钾废水中提取磷酸和氢氧化钾,写出电极反应式,判断离子交换膜,根据反应的比例关系确定磷酸的质量;
(5)先列出该反应的平衡常数的表达式,进而转化为溶度积之比。
(1)由流程图可知,电弧炉中发生的反应为Ca5(PO4)3F与焦炭、石英砂(主要成分为SiO2)在1500。C高温下反应生成CaSiO3、白磷、SiF4和CO,根据元素守恒、得失电子守恒配平该化学方程式,故答案为:![]() ;
;
(2)取质量分数为25%的硝酸100g,则溶质硝酸的质量为25g,溶剂水的质量为75g,则硝酸的质量摩尔浓度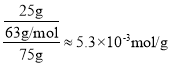 ,硝酸不稳定,温度过高,硝酸会大量分解,因此需要控制温度为75℃,故答案为:5.3;温度过高,硝酸会大量分解;
,硝酸不稳定,温度过高,硝酸会大量分解,因此需要控制温度为75℃,故答案为:5.3;温度过高,硝酸会大量分解;
(3)由流程图可知,反应槽中磷酸与碳酸氢根反应生成磷酸二氢根、水和二氧化碳,符合强酸制弱酸,从而得到KH2PO4,发生反应的离子方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(4)已知通过图示电解系统可从磷酸二氢钾废水中提取磷酸和氢氧化钾,阳极发生反应![]() ,膜2为阴离子交换膜,中间隔室的磷酸二氢根离子移动向阳极,与氢离子结合生成磷酸
,膜2为阴离子交换膜,中间隔室的磷酸二氢根离子移动向阳极,与氢离子结合生成磷酸![]() ,阴极发生反应2H2O+2e- = H2↑+2OH-,膜1为阳离子交换膜,中间隔室的钾离子移动向阴极,在阴极得到氢氧化钾,转移0.15mol电子,阳极生成0.15mo氢离子,会有0.15molH2PO4-移动向阳极生成0.15mol H3PO4,则理论上获得磷酸的质量为0.15mol×98g/mol=14.7g,故答案为:阳离子;
,阴极发生反应2H2O+2e- = H2↑+2OH-,膜1为阳离子交换膜,中间隔室的钾离子移动向阴极,在阴极得到氢氧化钾,转移0.15mol电子,阳极生成0.15mo氢离子,会有0.15molH2PO4-移动向阳极生成0.15mol H3PO4,则理论上获得磷酸的质量为0.15mol×98g/mol=14.7g,故答案为:阳离子;![]() ;14.7;
;14.7;
(5)该反应的平衡常数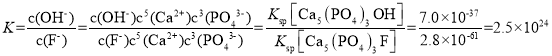 ,故答案为:2.5×1024。
,故答案为:2.5×1024。

 阅读快车系列答案
阅读快车系列答案