题目内容
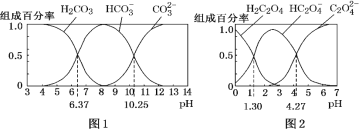
【题目】H2CO3 和 H2C2O4 都是二元弱酸,常温下,不同 pH环境下它们不同形态的粒子的组成百分率如图所示:
下列说法正确的是( )
A.在 pH为6.37及10.25时,溶液均存在 c(H2CO3)=c(HCO3-)=c(CO32-)
B.反应 CO32-+H2O![]() HCO3-+OH- 的平衡常数为10-7.23
HCO3-+OH- 的平衡常数为10-7.23
C.0.1 mol·L-1NaHC2O4 溶液中 c(HC2O4-)>c(H2C2O4)>c(C2O42-)
D.往Na2CO3溶液中加入少量草酸溶液,发生反应:2CO32+H2C2O4=2HCO3+C2O42
【答案】D
【解析】
A.pH=6.37时,c(H2CO3)=c(HCO3),溶液中几乎不存在CO32,pH=10.25时,c(HCO3)=c(CO32),溶液中几乎不存在H2CO3,A错误;
B. 反应CO32-+H2O![]() HCO3-+OH-,为CO32-的水解平衡,pH=10.25时,溶液中c(HCO3)=c(CO32),所以
HCO3-+OH-,为CO32-的水解平衡,pH=10.25时,溶液中c(HCO3)=c(CO32),所以 ,B错误;
,B错误;
C. 当pH=4.27时,c(C2O42-)=c(HC2O4),HC2O4的电离平衡常数为10-4.27,当pH=1.30时,c(H2C2O4)=c(HC2O4),HC2O4的水解平衡常数为10-12.7,所以HC2O4电离大于水解,NaHC2O4溶液显酸性,离子浓度大小关系为:c(HC2O4-)>c(C2O42-)>c(H2C2O4),C错误;
D. 根据图象,当溶液pH=1.30时,溶液中c(H2C2O4)=c(HC2O4),则H2C2O4的一级电离常数为K1=101.30,所以H2C2O4的酸性强于H2CO3,同时也强于HCO3-的酸性,所以往Na2CO3溶液中加入少量草酸溶液,能发生反应2CO32+H2C2O4=2HCO3+C2O42,D正确;
故答案为D。

 阅读快车系列答案
阅读快车系列答案