题目内容
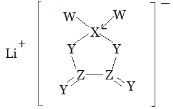
【题目】W、X、Y、Z是同周期主族元素,Y 的最外层电子数是 X 次外层电子数的 3倍,四种元素与锂组成的盐是一种新型电池的电解质(结构如图,箭头指向表示共用电子对由 W 提供)。下列说法不正确的是( )
A.W的非金属性比Y的强
B.原子半径Z比X大
C.该物质中含离子键和共价键
D.该物质中Ⅹ原子满足8电子稳定结构
【答案】B
【解析】
Y的最外层电子数是X次外层电子数的3倍,X的次外层电子数为2,Y的最外层电子数为6,Y为氧元素;由盐的结构简式可知,Z可以形成四个共价键,且能与氧形成双键,因此Z的最外层电子数为4,Z为碳元素;X能形成3个共价键,且能提供空轨道接受W提供的共用电子对,因此X为硼元素;四种元素位于同周期,且W能形成一个共价键,W为氟元素,所以W、X、Y、Z分别为F、B、O、C。
A. W为F,Y为O,同一周期从左往右元素的非金属性逐渐增强,非金属性:F>O,A正确;
B. Z为C,X为B,同一周期从左往右元素原子半径减小,原子半径:B>C,B错误;
C. 该物质中锂离子和阴离子之间的化学键为离子键,阴离子中含有共价键,C正确;
D. X为B,能形成3个共价键,且能提供空轨道接受W提供的共用电子对,能满足8电子稳定结构,D正确;故答案为:B。

【题目】已知A(g)+B(g)![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K=___,ΔH___0(填“<”“>”或“=”)。
(2)830℃时,向一个5L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003molL-1s-1,则6s时c(A)=___molL-1,C的物质的量为___mol;若反应经一段时间后,达到平衡时A的转化率为___,如果这时向该密闭容器中再充入1mol氩气,平衡时A的转化率为___。
(3)一定温度下,能判断该反应达化学平衡状态的是___。
①单位时间内生成nmolA,同时消耗nmolC
②A的转化率不变
③容器内压强不再变化
④混合气体的密度不再变化
⑤混合气体的平均相对分子质量不再变化
(4)1200℃时,C(g)+D(g)![]() A(g)+B(g)的平衡常数的值为___。
A(g)+B(g)的平衡常数的值为___。