��Ŀ����
����Ŀ��ͭ����Ļ������ڻ�����ҽҩ���ϵ�������й㷺����;���ش���������:
��1��ԭ�ӹ����ָ������ԭ�Ӻ����___________����̬Sԭ�ӵ�ԭ�ӹ������____����
��2����̬Cuԭ����,�������ռ�ݵ�ԭ�ӹ��Ϊ���ε�����ܼ�������______��ռ�ݸ��ܼ��ĵ�����Ϊ__________��
��3��Cl��S��Se��Ԫ�����ڱ��д������ڵ�λ��,���һ�����ܵĴ�С˳��Ϊ_______��
��4����ͼ�Ǻ�Ԫ��Cu��S���л���Ľṹ��ʽ:

�ٸ��л�������ṹ�к��еĻ�ѧ��������_______(�������ۼ��������Ӽ����������ۼ������Ӽ���)����λ��,����1�����л����������λ����Ϊ_____��,��Щ��λ�����ṩ�µ��ӶԵ�Ԫ����__________��
��Sԭ�ӵ��ӻ���ʽΪ_______����*Nԭ�ӵ��ӻ���ʽΪ_______��
��5����ͼ��Cu-Au�Ͻ��һ����������ṹ:

��֪�úϽ���ܶȷ�dg/cm3,�����ӵ�������ֵΪNA����Auԭ�ӵİ뾶Ϊbpm(lpm=10-10cm)����ͭԭ�ӵİ뾶Ϊ______cm(д���������ʽ)��
���𰸡� �ռ��˶�����Ҫ���� 9 4s 1 Cl>S>Se ���ۼ� 2 N��O sp3 sp2 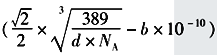
����������1��ԭ�ӹ����ָ������ԭ�Ӻ���Ŀռ��˶�����Ҫ����̬Sԭ�ӵĵ����Ų�ʽΪ1s22s22p63s23p4��s���ֻ��1�������p�����3�������������ԭ�ӹ������9����
��2����̬Cuԭ�������������ռ�ݵ�ԭ�ӹ��Ϊ���ε�����ܼ�������4s��ռ�ݸ��ܼ��ĵ�����Ϊ1��
��3��Cl��S��Se��Ԫ�����ڱ��д������ڵ�λ����Cl��Sͬ������S��Seͬ���壬��ǽ�������ǿ������˳��ΪCl>S>Se�����һ�����ܵĴ�С˳��ΪCl>S>Se��
��4���ٸ��л�������ṹ�к��еĻ�ѧ�������ǹ��ۼ�����λ�������л��������Cuԭ����3��Nԭ�Ӻ�1��Oԭ�ӳɼ�������N��O��ԭ�ӽṹ����ɼ�����������ж� 1�����л����������λ������ĿΪ2������Щ��λ�����ṩ�µ��ӶԵ�Ԫ����N��O��
�ڸ��л��������Sԭ��ֻ�γ���2���Ҽ�����Sԭ�ӵ��ӻ���ʽΪsp3����*Nԭ�ӹ��γ�3��������1�������������ӻ���ʽΪsp2��
��5����Cu-Au�Ͻ�ľ���ṹ��֪���侧����Cu��Auԭ�ӷֱ�λ�ھ��������ĺͶ��㣬���Ծ�����Cu��Auԭ�����ֱ�Ϊ3��1����֪�úϽ���ܶȷ�dg/cm3,�����ӵ�������ֵΪNA����Auԭ�ӵİ뾶Ϊbpm(lpm=10-10cm)����Cuԭ�ӵİ뾶Ϊx�������ı߳�Ϊa����![]() ��a=
��a=![]() pm��NA������������������ֱ�Ϊ389g��
pm��NA������������������ֱ�Ϊ389g��![]() ������
������![]() ����ͭԭ�ӵİ뾶Ϊ
����ͭԭ�ӵİ뾶Ϊ![]() cm��
cm��

����Ŀ����Ϊ��ҵ�����Ĵ������Ʊ�����MgO�IJ���������þ(MgC2O4��2H2O)���Ź�����Ӧ�úͷ�չǰ�����ش�����������
��1��MgC2O4��2H2O���Ʊ�

��֪�Ȼ�þ������李�����þ��ˮ�е��ܽ�����±�:
�Ȼ�þ | ����� | ����þ | |
20�� | 54.6g | 4.45g | �� |
70�� | 61.0g | 22.4g | |
100�� | 73.3g | 34.7g |
ʵ�鷽��:��i�������������ˮ��ȡ300mL��ȴ��70��,��140g MgCl2��6H2O������MgCl2��Һ��
��ii������ͼʾװ��װ��ҩƷ�����Ӻ�װ����
��iii���ڴ������Ƚ��������£��������뱥��(NH4)2C2O4��Һ����ˮԡ���ȣ�ֱ�����ٲ�����ɫ����Ϊֹ��
��iv�����������ϴ�ӣ���MgC2O4��2H2O������
��װ����������������_____,����ˮ��ˮ��Ϊ_____����a������b��)��
����������c���������____________________��
�������Ʒϴ�Ӹɾ��ķ�����________________��
��2��MgC2O4��2H2O�ֽ�����̽��
������ͼ��ʾװ��̽��MgC2O4��2H2O�ֽ����CO��CO2 �ȵ����ʡ�
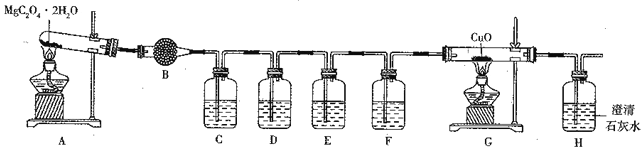
��A�з�����Ӧ�Ļ�ѧ����ʽΪ______________________��
��װ��B��ʢװ��ҩƷ��_____��װ��C��������______��װ��D�е��Լ���______��װ��G�е�������____________________��


