题目内容
【题目】锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)Ge在周期表中的位置__________,基态Ge原子的核外电子排布式为[Ar] _______,有 __________个未成对电子。
(2)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Ge、O两元素电负性由大至小的顺序是 _________。
(3)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为 ________,微粒之间存在的作用力是___________。
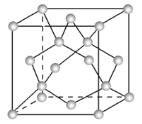
(4)晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76 pm(1pm=10-12m),其密度为_______g·cm-3(列出计算式即可)。
【答案】第四周期 ⅣA族 3d104s24p2 2 O>Ge sp3 共价键 ![]()
【解析】
(1)Ge是32号元素,位于第四周期第IVA族,基态Ge原子核外电子排布式为[Ar]3d104s24p2;
(2)元素的非金属性越强,吸引电子的能力越强,元素的电负性越大;
(3)Ge单晶具有金刚石型结构,Ge原子与周围4个Ge原子形成正四面体结构,向空间延伸的立体网状结构,属于原子晶体,Ge原子之间形成共价键,Ge原子杂化轨道数目为4,采取sp3杂化;
(4)Ge单晶具有金刚石型结构,则晶胞中Ge原子数目为8,结合阿伏伽德罗常数表示出晶胞的质量,再根据密度公式计算可得。
(1)Ge的原子序数为32,位于元素周期表第四周期IVA族,基态Ge原子核外电子排布式为 [Ar]3d104s24p2,在最外层的4s能级上2个电子为成对电子,4p轨道中2个电子分别处以不同的轨道内,有2轨道未成对电子,故答案为:第四周期 ⅣA族;3d104s24p2;2;
(2)元素的非金属性越强,吸引电子的能力越强,元素的电负性越大,元素非金属性: Ge<O,则电负性:O>Ge,故答案为:O>Ge;
(3)Ge单晶具有金刚石型结构,Ge原子与周围4个Ge原子形成正四面体结构,向空间延伸的立体网状结构,属于原子晶体,Ge原子之间形成共价键,Ge原子杂化轨道数目为4,采取sp3杂化,故答案为:sp3;共价键;
(4)由晶胞结构可知,晶胞中Ge原子有8个位于顶点、6个位于面心,4个位于体内,由分摊法可知数目为8×![]() +6×
+6×![]() +4=8,则依据质量公式可得晶胞质量为
+4=8,则依据质量公式可得晶胞质量为![]() g,晶胞参数a=565.76pm,其密度为
g,晶胞参数a=565.76pm,其密度为![]() =
=![]() gcm-3,故答案为:
gcm-3,故答案为:![]() 。
。

 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案【题目】某温度时,两个恒容密闭容器中仅发生反应2NO2(g)2NO(g) +O2(g) ΔH > 0。实验测得:υ正(NO2)=k正c2(NO2),υ逆(NO)=k逆c2(NO)·c(O2),k正、k逆为化学反应速率常数,只受温度影响。
容器 编号 | 起始浓度(mol·L1) | 平衡浓度(mol·L1) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
Ⅰ | 0.6 | 0 | 0 | 0.2 |
Ⅱ | 0.6 | 0.1 | 0 | |
下列说法不正确的是
A.Ⅰ中NO2的平衡转化率约为66.7%
B.Ⅱ中达到平衡状态时,c(O2)<0.2mol·L1
C.该反应的化学平衡常数可表示为![]()
D.升高温度,达到平衡状态时 Ⅰ中c(O2)<0.2mol·L1
【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 将Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液,溶液变红 | 原Fe(NO3)2样品已变质 |
B | 向蛋白质溶液中分别加入甲醛和(NH4)2SO4饱和溶液,均有固体析出 | 蛋白质均发生了变性 |
C | 向2 mL 0.5 mol·L-1 NaHCO3溶液中滴加1 mL 0.5 mol·L-1 CaCl2溶液,产生白色沉淀和气体 | 白色沉淀和气体分别为CaCO3和CO2 |
D | 向溶有SO2的BaCl2溶液中通入气体X,出现白色沉淀 | 气体X一定具有强氧化性 |
A.AB.BC.CD.D
【题目】现向下列装置中缓慢通入气体X,分别进行关闭和打开活塞K的操作,则品红溶液和澄清石灰水中现象相同的一组是
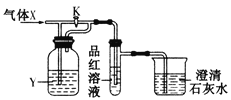
选项 | A | B | C | D |
X | NO2 | SO2 | Cl2 | CO2 |
Y(过量) | 浓H2SO4 | NaHCO3饱和溶液 | Na2SO3溶液 | NaHSO3饱和溶液 |
A.AB.BC.CD.D
【题目】浙江师范大学的研究团队研究获得了一类具有高活性和选择性的钙钛矿光催化剂(![]() ),这一成果发表在2020年1月Chem. Mater.上。带有负电荷的CsPbBr3将带正电的
),这一成果发表在2020年1月Chem. Mater.上。带有负电荷的CsPbBr3将带正电的![]() 固定在其表面,用于可见光驱动CO2还原。
固定在其表面,用于可见光驱动CO2还原。

(1)写出Ni基态原子的价电子排布图(轨道表达式)___________________。
(2)C、N、O、Cs、Pb元素第一电离能由大到小的顺序是____________________。
(3)![]() 是二价阳离子,该离子中氮原子的杂化类型为_________,该离子结构中含有_________(填字母)。
是二价阳离子,该离子中氮原子的杂化类型为_________,该离子结构中含有_________(填字母)。
a.离子键 b.配位键 C.π键 d.氢键
(4)某些氧化物的熔点数据如下表所示:
氧化物 | CO2 | Cs2O | PbO |
熔点/℃ | -56.6 | 490 | 888 |
解释表中氧化物之间熔点差异的原因:______________________________。
(5)氮化镓是一种半导体材料。晶胞结构可看作金刚石晶胞内部的碳原子被N原子代替,顶点和面心的碳原子被Ga原子代替。
①与同一个Ga原子相连的N原子构成的空间构型为__________;
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。若沿y轴投影的晶胞中所有原子的分布图如图,则2、3、4原子的分数坐标不可能的是(________________)
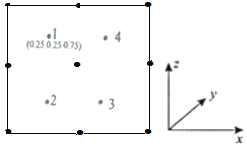
a.(0.75,0.25,0.25) b.(0.25,0.75,0.75)
c.(0.25,0.75,0.25) d.(0.75,0.75,0.75)
③ GaN晶体中N和N的原子核间距为a pm,GaN摩尔质量为![]() ,阿伏加德罗常数的值为NA,则GaN晶体的密度为___________
,阿伏加德罗常数的值为NA,则GaN晶体的密度为___________![]() (
(![]() )。
)。