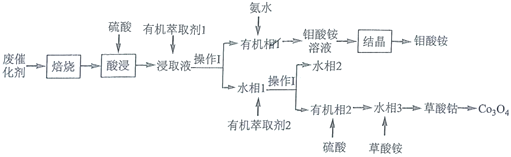
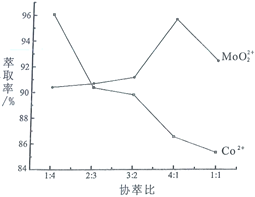
题目内容
【题目】通常监测SO2含量是否达到排放标准的反应原理是SO2+H2O2+BaCl2=BaSO4↓+2HCl。设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.0.1molBaCl2晶体中所含离子总数为0.2NA
B.25℃时,pH=1的HC1溶液中含有H+的数目为0.1NA
C.17gH2O2中含有非极性键数目为0.5NA
D.生成2.33gBaSO4沉淀时,转移电子数目为0.01NA
【答案】C
【解析】
A.氯化钡是由一个钡离子和2个氯离子形成的离子晶体,则0.1molBaCl2晶体中所含离子总数为0.3NA,故A错误;
B.缺溶液的体积,无法计算25℃时pH=1的HC1溶液中H+的物质的量和数目,故B错误;
C.过氧化氢含有2个氢氧极性键和1个氧氧非极性键,17g过氧化氢的物质的量为![]() =0.5mol,则0.5mol过氧化氢中含有非极性键数目为0.5NA,故C正确;
=0.5mol,则0.5mol过氧化氢中含有非极性键数目为0.5NA,故C正确;
D.由化学方程式可知,生成1mol硫酸钡转移电子的物质的量为2mol,2.33g硫酸钡的物质的量为![]() =0.01mol,则生成1mol硫酸钡沉淀时,转移电子数目为0.02NA,故D错误;
=0.01mol,则生成1mol硫酸钡沉淀时,转移电子数目为0.02NA,故D错误;
故选C。

【题目】硫化氢分解制取氢气和硫磺的反应原理为2H2S(g)![]() S2(g)+2H2(g),在2.0 L恒温恒容密闭容器中充入2.0 mol H2S,反应过程中的部分数据如下表所示:
S2(g)+2H2(g),在2.0 L恒温恒容密闭容器中充入2.0 mol H2S,反应过程中的部分数据如下表所示:
n/mol t/min | n(H2S) | n(S2) | n(H2) |
0 | 2.0 | 0 | 0 |
2 | 1.0 | ||
4 | 0.8 | ||
6 | 0.6 |
下列说法不正确的是( )
A.0~2min 生成H2的平均反应速率为0.25 mol·L-1·min-1
B.上述反应的平衡常数K=0.675
C.3分钟时,H2S的分解率一定小于60%
D.平衡后,向容器中通入少量O2,平衡正向移动
【题目】探究铁在某浓度H3PO4和H2O2的混合溶液中反应的情况,进行如下实验:
实验 | 操作 | 现象 |
Ⅰ | 将除去氧化膜的铁钉置于烧杯中,加入30mL1.0molL-1H3PO4和3mL30%H2O2的混合溶液(pH≈1)。 | 一段时间后铁钉表面突然产生大量气泡,随后停止产生气泡;一段时间后再产生大量气泡,再停止,出现周而往复的现象。过程中,溶液保持澄清。
|
Ⅱ | 将与实验Ⅰ相同的铁钉放入烧杯中,加入30mL1.0molL-1H3PO4和3mLH2O。 | 片刻后铁钉表面持续产生气泡,溶液保持澄清。 |
已知:Fe3(PO4)2难溶于水,Fe(H2PO4)2溶于水。
(1)用85%H3PO4配制100mL1.0mol·L-1H3PO4所用的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管、______。
(2)请结合实验Ⅱ中现象,分析铁钉与H3PO4反应的产物_______。
(3)探究实验Ⅰ中停止产生气泡的原因。
提出假设:铁钉表面形成了含有+3价铁的氧化膜将铁钉覆盖。甲同学进行实验Ⅲ,得出假设成立的结论。
实验Ⅲ:将洗净的实验Ⅰ中无气泡产生时的铁钉置于试管中,加入滴有KSCN溶液的稀H2SO4,振荡,静置,溶液呈红色。
乙同学认为实验Ⅲ无法证实假设成立,其理由是未排除O2的干扰,请解释O2是如何干扰实验的:_____。
乙同学通过改进实验证实了假设成立。
(4)铁钉表面突然产生大量气泡的可能原因是Fe2+迅速被H2O2氧化形成氧化膜,使聚集在铁钉表面的H2脱离铁钉表面。形成氧化膜(以Fe3O4计)的离子方程式是____。
(5)实验Ⅰ中周而往复的现象与铁钉表面氧化膜的生成和溶解密切相关,从反应的速率角度分析其原因:______。