题目内容
【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 将Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液,溶液变红 | 原Fe(NO3)2样品已变质 |
B | 向蛋白质溶液中分别加入甲醛和(NH4)2SO4饱和溶液,均有固体析出 | 蛋白质均发生了变性 |
C | 向2 mL 0.5 mol·L-1 NaHCO3溶液中滴加1 mL 0.5 mol·L-1 CaCl2溶液,产生白色沉淀和气体 | 白色沉淀和气体分别为CaCO3和CO2 |
D | 向溶有SO2的BaCl2溶液中通入气体X,出现白色沉淀 | 气体X一定具有强氧化性 |
A.AB.BC.CD.D
【答案】C
【解析】
A.向Fe(NO3)2溶液中滴加稀硫酸,酸性条件下硝酸根离子与亚铁离子发生氧化还原反应生成铁离子,结论不合理,故A错误;
B. 浓的无机盐溶液能使蛋白质发生盐析产生沉淀,向蛋白质溶液中加入 (NH4)2SO4饱和溶液,有固体析出是蛋白质发生盐析,不是变性,故B错误;
C. NaHCO3溶液中存在电离平衡HCO3-![]() CO32-+H+,向2 mL 0.5 mol·L-1 NaHCO3溶液中滴加1 mL 0.5 mol·L-1 CaCl2溶液,钙离子与碳酸根反应生成碳酸钙沉淀,使电离平衡向右移动,电离出的氢离子与过量的碳酸氢根离子反应生成二氧化碳和水,则白色沉淀和气体分别为CaCO3和CO2,故C正确;
CO32-+H+,向2 mL 0.5 mol·L-1 NaHCO3溶液中滴加1 mL 0.5 mol·L-1 CaCl2溶液,钙离子与碳酸根反应生成碳酸钙沉淀,使电离平衡向右移动,电离出的氢离子与过量的碳酸氢根离子反应生成二氧化碳和水,则白色沉淀和气体分别为CaCO3和CO2,故C正确;
D. 向溶有SO2的BaCl2溶液中通入氨气,氯化钡、二氧化硫和氨气反应生成亚硫酸钡白色沉淀,氨气表现碱性,不表现氧化性,故D错误;
故选C。

 阅读快车系列答案
阅读快车系列答案【题目】下列实验中,对应的操作、现象及实验原理或结论均正确的是
实验目的 | 操作和现象 | 实验原理或结论 | |
A | 验证AgI和 AgCl的 Ksp大小 | 向1mL 1mol·L-1NaCl溶液中滴加2滴 2mol·L-1 AgNO3溶液,生成白色沉淀;再滴加 2滴1mol·L-1KI溶液,白色沉淀变成黄色沉淀 | AgCl(s)+I-(aq) |
B | 比较HClO和 HF溶液的酸性 | 室温下,用pH试纸分别测定浓度为0.1mol·L-1NaClO 溶液、0.1mol·L-1NaF 溶液的pH | 酸越弱,酸根离子水解程度越大,其盐溶液碱性越强 |
C | 提纯混有少量硝酸钾的氯化钠固体 | 在较高温度下制得浓溶液再冷却结晶、过滤、干燥 | 氯化钠溶解度随温度升高变化不大,而硝酸钾溶解度随温度升髙显著增大 |
D | 检验某溶液中是否含有CO32- | 先滴加盐酸产生气泡,将该气体通入澄清石灰水中,有白色沉淀生成 | 该溶液中一定含有CO32- |
A. AB. BC. CD. D
【题目】用下列装置能达到实验目的的是
A |
| 淸洗铜与浓硫 酸反应后有残 液的试管 | B |
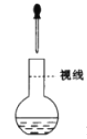
| 配置一定物质的量浓度的溶液实验中,为定容时的操作 |
C |
| 以淀粉为指示 剂,用酸式滴 定管盛放 Na2S2O3标准溶液进行滴定 | D |
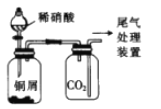
| 装置为制备并用 排气法收集NO 气体的装置(稀硝酸+钢屑) |
A. AB. BC. CD. D