题目内容
在标准状况下,将11.2L氢气在氯气中完全燃烧,放出92.4KJ热量,下列所示的热化学方程式正确的是( )
| A.H2(g)+Cl2(g)=1/2HCl(g) ΔH=92.4KJ/mol |
| B.H2(g)+Cl2(g)=1/2HCl(g) ΔH=-92.4KJ/mol |
| C.H2(g)+Cl2(g)=2HCl(g) ΔH=-184.8KJ/mol |
| D.H2(g)+Cl2(g)=2HCl(l) ΔH=184.8/mol |
C
反应放热, ΔH<0,应从 B、C 中选,方程式中是1mol氢气反应,应放出184.8KJ的热量,故C 正确

练习册系列答案
相关题目
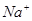
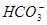
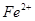
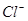
 变化的判断中,错误的是
变化的判断中,错误的是 H+ + A2-。
H+ + A2-。 OH-)>c(HA-)>c(H+)
OH-)>c(HA-)>c(H+)