题目内容
下列有关0.1 mol?L-1NaHCO3溶液中离子浓度的关系式,正确的是
| A.c(Na+)> c(HCO3-)> c(CO32-)> c(H+)> c(OH-) |
| B.c(Na+)> c(CO32-)> c(HCO3-)> c(OH-)> c(H+) |
| C.c(Na+)= c(HCO3-) + 2c(CO32-) + c(H2CO3 |
| D.c(Na+) + c(H+)= c(HCO3-) + 2c(CO32-) + c(OH-) |
D
各离子浓度大小为c(Na+)> c(HCO3-)> c(OH-)> c(H+)> c(CO32-)
HCO3-在溶液中即水解又电离,但水解程度大于电离程度,溶液显碱性
C错,应为c(Na+)= c(HCO3-) + c(CO32-) + c(H2CO3)
D对 根据质子守恒,溶液中阳离子带的正电荷总数等于阴离子带的负电荷总数
HCO3-在溶液中即水解又电离,但水解程度大于电离程度,溶液显碱性
C错,应为c(Na+)= c(HCO3-) + c(CO32-) + c(H2CO3)
D对 根据质子守恒,溶液中阳离子带的正电荷总数等于阴离子带的负电荷总数

练习册系列答案
相关题目
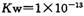 ,下列叙述正确的是
,下列叙述正确的是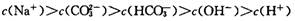
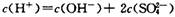
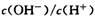 随之增大
随之增大 增大
增大 H++OH-,下列叙述中正确的是
H++OH-,下列叙述中正确的是