��Ŀ����
����Ŀ�������£���0.1L0.2mol/LKMnO4������Һ��һ����pH=3�IJ��ᣨHOOC-COOH����Һ��ϣ��ų�VL���塣NA���������ӵ�������ֵ������˵����ȷ����
A. pH=3�IJ�����Һ����H+��ĿΪ0.001NA
B. ��1molKMnO4����ԭʱǿ���ṩH+��ĿΪNA
C. 1molHOOC-COOH�����õ��Ӷ���ĿΪ9NA
D. �÷�Ӧ�ͷ�CO2������ĿΪ![]()
���𰸡�C
��������A��û�и�����Һ����������㣬ѡ��A����B�����ݷ�Ӧ2MnO4-+ 5HOOC-COOH +6H+=2Mn2++10CO2��+8H2O��֪����1molKMnO4����ԭʱǿ���ṩH+��ĿΪ3NA��ѡ��B����C��C. HOOC-COOH�����к��ж���̼��˫����һ��̼̼����������̼��������������������ÿ�����ӹ��й�9�Թ��õ��Ӷԣ���1molHOOC-COOH�����õ��Ӷ���ĿΪ9NA��ѡ��C��ȷ��D�����DZ�״���£�������22.4L/mol���㣬��ȷ����ѡ��D����ѡC��

����Ŀ���Թ�ʯ(��Ҫ�ɷ�SiO2)Ϊ��ʼԭ�������ߴ��ྦྷ��ļ�����������ͼ��ʾ��
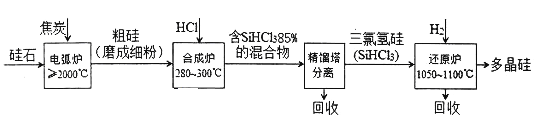
(1)�ڵ绡¯�У����ɴֹ�Ļ�ѧ����ʽΪ____________���÷�Ӧ�������뻹ԭ�����ʵ���֮��Ϊ_____________��
(2)�ϳ�¯���йط�Ӧ���������±���ʾ��
�Ȼ�ѧ����ʽ | ƽ�ⳣ�� | |
����Ӧ | Si(s)+3HCl(g) | K1 |
����Ӧ | Si(s)+4HCl(g) | K2 |
������Ӧ���¶����ϸ������280��300��֮�䣬���¶ȹ��ͣ���__________________�����¶�̫�ߣ�SiHCl3���ת������SiCl4����ת�����Ȼ�ѧ����ʽΪ_____________________��
��ƽ��ʱ��![]() ��ֵa����
��ֵa����![]() ��ֵb�ı仯���仯����
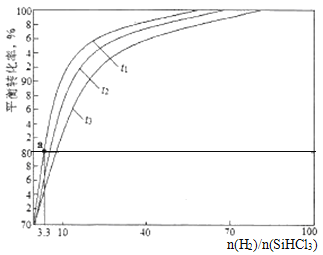
��ֵb�ı仯���仯����![]() =______(�ú�K1��K2�Ĵ���ʽ��ʾ)����ҵ����H2�ʵ�ϡ��HCl�����
=______(�ú�K1��K2�Ĵ���ʽ��ʾ)����ҵ����H2�ʵ�ϡ��HCl�����![]() ��ֵ������ƽ���ƶ�ԭ�����Խ���________________________��
��ֵ������ƽ���ƶ�ԭ�����Խ���________________________��
(3)��ԭ¯�е���Ҫ��ӦΪSiHCl3(g)+H2(g)=Si(s)+3HCl(g) ��H>0��ʵ��������1.0L�ܱ��������о��õ�SiHCl3��ת�����ڲ�ͬ�¶���������n(H2)/(SiHCl3)�仯��������ͼ��ʾ��t1��t2��t3��ʾ���¶ȸߵ�˳��Ϊ_______��t1�¶�ʱƽ�ⳣ��Ka=______(������λС��)��