题目内容
【题目】硫酸盐和金属硫化物在工农业生产中有广泛的应用。
(1)已知:
反应Ⅰ:CaSO4(s)+CO(g)=CaO(s)+SO2(g)+CO2(g)△H1=+218.4 kJ·mol-1
反应Ⅱ:CaSO4(s)+4CO(g)=CaS(s)+4CO2(g) △H2=-175.6kJ·mol-1
反应 Ⅲ:3CaSO4(s)+CaS(s)=4CaO(s)+4SO2(g) (B) △H3
①△H3=__________。
②能使反应Ⅰ、Ⅱ速率加快的措施有____________________________________(写出两条)。
③已知某温度下反应Ⅰ的反应速率小于反应Ⅱ的反应速率,则图1中曲线a表示__________ (填“反应Ⅰ”或“反应Ⅱ”)。


(2)在2L密闭容器中,加入0.1molMoS2(硫化钼)、0.2molNa2CO3和0.4molH2,发生反应MoS2(s)+2Na2CO3 (s)+4H2(g)![]() Mo(s)+2CO(g)+4H2O(g)+2Na2S(s),达到平衡时三种气体的物质的量分数随温度变化的曲 线如图2所示。
Mo(s)+2CO(g)+4H2O(g)+2Na2S(s),达到平衡时三种气体的物质的量分数随温度变化的曲 线如图2所示。
①反应速率:P点______ Q点(填“<” “>”或“=”),其判断理由是_____________。
②气体总压:P点__Q点(填“<” “>”或“=”),其判断理由是_____________。
③P点对应温度下,H2的平衡转化率为__________,平衡常数K=__________。
【答案】 +1049.2kJ·mol-1 增大反应体系压强、升高温度、加入催化剂、将固体硫酸钙碾碎等(写出其中的任意两条 反应Ⅰ < 从P点到Q点,温度升高,反应速率加快 < 从P点到Q点,温度升高,平衡向正反应方向移动,密闭容器中气体分子数增多 50% 2.5×10-3
【解析】试题分析:(1) ①根据盖斯定律计算△H3;②根据影响反应速率的因素分析;③反应Ⅰ是吸热反应、反应Ⅱ是放热反应;(2) ①Q点温度大于P点;②从P点到Q点,氢气的含量减小,平衡正向移动,密闭容器中气体分子数增多;③利用“三段式”计算;
解析:(1) ①反应Ⅰ:CaSO4(s)+CO(g)=CaO(s)+SO2(g)+CO2(g)△H1=+218.4 kJ·mol-1
反应Ⅱ:CaSO4(s)+4CO(g)=CaS(s)+4CO2(g)△H2=-175.6kJ·mol-1
根据盖斯定律Ⅰ![]() -Ⅱ得3CaSO4(s)+CaS(s)=4CaO(s)+4SO2(g)(B)△H3=+1049.2kJ·mol-1;②能使反应Ⅰ、Ⅱ速率加快的措施有增大反应体系压强、升高温度、加入催化剂、将固体硫酸钙碾碎等;③反应Ⅰ是吸热反应、反应Ⅱ是放热反应;曲线a是表示吸热反应,所以曲线a是表示反应Ⅰ;(2) ①温度越高,反应速率越快,Q点温度大于P点,所以反应速率:P点<Q点;②从P点到Q点,氢气的含量减小,平衡正向移动,密闭容器中气体分子数增多,所以气体总压:P点<Q点;③P点对应温度下,氢气、水的体积分数相同,则
-Ⅱ得3CaSO4(s)+CaS(s)=4CaO(s)+4SO2(g)(B)△H3=+1049.2kJ·mol-1;②能使反应Ⅰ、Ⅱ速率加快的措施有增大反应体系压强、升高温度、加入催化剂、将固体硫酸钙碾碎等;③反应Ⅰ是吸热反应、反应Ⅱ是放热反应;曲线a是表示吸热反应,所以曲线a是表示反应Ⅰ;(2) ①温度越高,反应速率越快,Q点温度大于P点,所以反应速率:P点<Q点;②从P点到Q点,氢气的含量减小,平衡正向移动,密闭容器中气体分子数增多,所以气体总压:P点<Q点;③P点对应温度下,氢气、水的体积分数相同,则
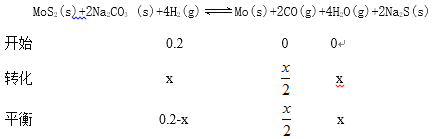
![]()
X=0.1
H2的平衡转化率为![]() ;平衡常数K=
;平衡常数K=![]() 2.5×10-3 。
2.5×10-3 。

 通城学典默写能手系列答案
通城学典默写能手系列答案【题目】在2 L密闭容器中,加入等物质的量的NO和O2,800℃时发生反应:2NO(g)+O2(g)→2NO2(g),其中n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应________(填“是”或“不是”)可逆反应。
(2)如图所示,表示NO2变化曲线的是______。
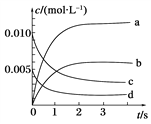
(3)用O2表示从0~2s内该反应的平均速率v=________,5s时O2的转化率为_____________。
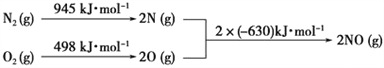
(4)NOx是汽车尾气中的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化如图所示。写出该反应的热化学方程式:_______________________。
(5)以N2和H2为反应物,盐酸酸化的NH4Cl溶液为电解质的原电池,工作原理如下图所示,下列说法不正确的是___________。
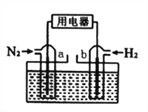
A.b电极为负极
B.反应过程中,溶液中的Cl-向a电极移动
C.a电极的电极反应式为:N2+6e-+8H+=2NH4+
D.电池反应为N2+3H2+2HCl=2NH4Cl