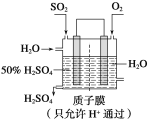
题目内容
【题目】一定温度下,反应X2(g)+H2(g)![]() 2HX(g)的平衡常数为100。若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于( )
2HX(g)的平衡常数为100。若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于( )
A. 5% B. 17% C. 25% D. 33%
【答案】B
【解析】试题分析:在一定温度下,反应H2(g)+ X2(g)![]() 2HX(g)的平衡常数为100,则2HX(g)
2HX(g)的平衡常数为100,则2HX(g)![]() H2(g)+ X2(g)的平衡常数为0.01,设该温度时HX(g)的最大分解率为x,
H2(g)+ X2(g)的平衡常数为0.01,设该温度时HX(g)的最大分解率为x,
2HX(g)![]() H2(g) + X2(g)
H2(g) + X2(g)
初始 1.0mol/L 0 0
反应 xmol/L![]() mol/L
mol/L![]() mol/L
mol/L
平衡 (1.0-x)mol/L![]() mol/L
mol/L![]() mol/L
mol/L
平衡常数=![]() =0.01,x=17%,故选B。
=0.01,x=17%,故选B。

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
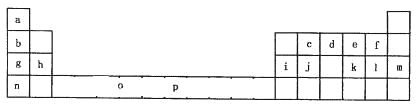
试回答下列问题:
(1)元素p为26号元素,请画出其基态原子外围电子排布图______________;
(2)e与a反应的产物的分子中中心原子的杂化形式为________________;该分子是_________(填“极性”或“非极性”)分子。
(3)上表中元素基态原子的第一电离最大的元素是__________。(用元素符号表示)
(4)o、p两元素的部分电离能数据列于下表:
元 素 | O | P | |
电离能 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难,对此,你的解释是______________;