题目内容
草酸亚铁(FeC2O4?2H2O)用作分析试剂及显影剂和新型电池材料磷酸亚铁锂的生产。已知:CO能与氯化钯(PdCl2)溶液反应生成黑色的钯粉。回答下列问题:
I.兴趣小组对草酸亚铁的分解产物进行实验和探究。
(1)将气体产物依次通过A、澄清石灰水,B、氯化钯,观察到A中澄清石灰水都变浑浊,B中出现黑色物质生成,则上述现象说明气体产物中有 。
(2)探究分解得到的固体产物中铁元素的存在形式。
①提出假设
假设1:________; 假设2:FeO; 假设3:FeO和Fe混合物
②设计实验方案证明假设3。
限选试剂: 1.0 mol?L-1盐酸、3% H2O2、0.1 mol?L-1CuSO4、20% KSCN、蒸馏水。
| 实验步骤 | 现象与结论 |
| 步骤1 :向试管中加入少量固体产物,再加入足量_________________,充分振荡 | 若溶液颜色明显改变,且有_______生成,则证明有铁单质存在 |
| 步骤2: 将步骤1中得到的浊液过滤,并用蒸馏水洗涤至洗涤液无色 | |
| 步骤3:取步骤2得到的少量固体与试管中, 滴加___________________________________ _______________________________________ | __________________________________ ___________________________________ |
II.某草酸亚铁样品中含有少量草酸(为方便于计算,草酸亚铁中草酸根和草酸分子均用C2O42-代替)。现用滴定法测定该样品中FeC2O4的含量。滴定反应分别是:5Fe2++MnO4-+8H+=5Fe3+ +Mn2++4H2O、5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O。
(3)实验方案设计为:
①将准确称量的0.20g草酸亚铁样品置于250 mL锥形瓶内,加入适量2 mol/L的H2SO4溶液,使样品溶解,加热至70℃左右,立即用浓度为0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记录数据。重复滴定2次。平均消耗V1 mL。
②向上述滴定混合液中加入适量的Zn粉和过量的2 mol/L的H2SO4溶液,煮沸5~8min,用KSCN溶液在点滴板上检验点滴液,直至溶液不立刻变红。将滤液过滤至另一个锥形瓶中,继续用0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记录数据。重复滴定2次。平均消耗V2 mL。
③若某小组的一次测定数据记录如下: V1= 18.90mL,V2=6.20mL。根据数据计算0.20g样品中:n(Fe2+)= ; n(C2O42-)= ;FeC2O4的质量分数为 (精确到0.01%,FeC2O4的式量为144)
(16分)I.(1)CO2、CO (2分) (2)① Fe (2分)
②实验步骤 现象与结论 步骤1:硫酸铜溶液(1分) 暗红色固体(1分) 步骤3:过量HCl,静置,取上层清液,滴加适量H2O2,充分振荡后滴加KSCN (2分) 若溶液呈血红色,则证明有FeO (2分)
II.(3)n(Fe2+)=0.0006200mol n(C2O42-)=0.0006350mol FeC2O4的质量分数为44.64%(每空2分,共6分)
解析试题分析:(1)根据草酸亚铁的组成及澄清石灰水变浑浊的现象推断,气体产物含有二氧化碳,根据已知信息及氯化钯溶液中出现黑色物质的现象推断,气体产物还有一氧化碳;(2)根据已知两种假设推断,假设1为Fe;根据金属活动顺序表中铁位于铜前面,单质铁与过量硫酸铜溶液能发生置换反应,能够析出红色固体,且除去铁单质,防止铁单质对氧化亚铁的检验造成干扰,因此可以选择稀硫酸铜溶液检验固体产物是否含有单质铁;氧化亚铁是碱性氧化物,不溶于硫酸铜溶液,根据碱性氧化物能溶于盐酸,生成的亚铁离子在酸性条件下易被双氧水氧化为铁离子,铁离子遇KSCN溶液变红,由此可以检验固体产物中的氧化亚铁;(3)由于步骤①②中先后发生的反应分别为5Fe2++5C2O42-+3MnO4-+24H+=5Fe3++10CO2↑+3Mn2++12H2O、2Fe3+ +Zn=2Fe2+ +Zn2+、5Fe2+ +MnO4-+8H+=5Fe3+ +Mn2++4H2O,其中铁元素守恒,因此根据步骤②可以计算出被高锰酸钾氧化的亚铁离子的物质的量,这也是样品中亚铁离子的物质的量;先用c?V=n求高锰酸钾或高锰酸根离子的物质的量,则n(MnO4-)=0.02000mol/L×6.20×10—3L;再由5Fe2+ +MnO4-+8H+=5Fe3+ +Mn2++4H2O中亚铁离子与高锰酸根离子的系数之比等于物质的量之比求n(Fe2+)=0.02000mol/L×6.20×10—3L×5=6.200×10—4mol,保留四位有效数字;由于步骤①反应为5Fe2++MnO4-+8H+=5Fe3+ +Mn2++4H2O、5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O,先用c?V=n求两反应中消耗高锰酸钾或高锰酸根离子总的物质的量,则n(MnO4-)=0.02000mol/L×18.90×10—3L;再根据高锰酸根离子总的物质的量—前反应中消耗高锰酸根离子的物质的量求后反应消耗高锰酸根离子的物质的量,即0.02000mol/L×18.90×10—3L—0.02000mol/L×6.20×10—3L=0.02000mol/L×12.70×10—3L;接着根据5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O中草酸根离子与高锰酸根离子的系数之比等于物质的量之比求n(C2O42-)= 0.02000mol/L×12.70×10—3L×5/2=6.350×10—4mol,保留四位有效数字;然后根据铁守恒关系式FeC2O4~Fe2+中草酸亚铁与亚铁离子的系数之比等于物质的量之比,求n(FeC2O4)= 6.200×10—4mol,由于草酸亚铁的式量为144,根据n?M=m求草酸亚铁的质量,即m(FeC2O4)= 6.200×10—4mol×144g/mol= 8.928×10—2g;最后,根据草酸亚铁的质量除以样品的质量求样品中草酸亚铁的质量分数,即FeC2O4的质量分数= 8.928×10—2g /0.2g×100%=44.64%,保留四位有效数字。
考点:考查化学实验方案的设计与评价,涉及气体产物成分的推断、提出固体产物成分的合理假设、设计方案检验固体产物中的铁和氧化亚铁、氧化还原滴定原理、物质的量浓度与物质的量的计算、物质的量在离子方程式计算中的应用、样品中草酸亚铁质量分数的计算等。

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案草酸亚铁晶体(FeC2O4·2H2O)呈淡黄色。某课题组为探究草酸业铁晶体的化学性质, 进行了一系列实验探究。
(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到二氧化碳气体生成。这说明草酸亚铁晶体具有 (填“氧化性”、“还原性”或“碱性”)。若反应中消耗1 mol FeC2O4·2H2O,则参加反应的KMnO4为 mol。
(2)资料表明:在密闭容器中加热到一定温度时,草酸亚铁晶体可完全分解,生成几种氧化物,残留物为黑色固体。课题组根据课本上所介绍的铁的氧化物的性质,对黑色固体的组成提出如下假设,请你完成假设二和假设三:
假设一:全部是FeO
假设二:
假设三:
(3)为验证上述假设一是否成立,课题组进行如下研究。
【定性研究】请你完成下表中内容。
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 取少量黑色固体, | |
【定量研究】课题组在文献中查阅到,FeC2O4·2H2O受热分解时,固体质量随温度变化的曲线如下图所示,写出加热到400℃时,FeC2O4·2H2O晶体受热分解的化学方程式为: 。
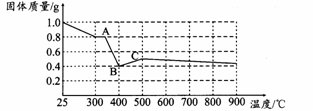
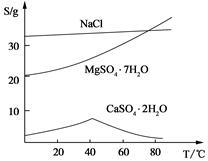
根据图象,如有1.0 g草酸亚铁晶体在坩埚中敞口充分加热,最终残留黑色固体的质量大于0.4 g。某同学由此得出结论:假设一不成立。你是否同意该同学的结论,并简述理由:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
| | 苯 | 溴 | 溴苯 |
| 密度/g·cm-3 | 0. 88 | 3. 10 | 1. 50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
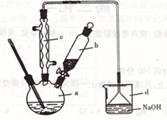
按下列合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑。在b中小心加入4.0mL液溴。向a中滴人几滴液溴,有白雾产生,是因为生成了 气体。继续滴加至液溴滴完。装置d的作用是_________________________ 。
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入l0mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mLl0%的NaOH溶液、l0mL水洗涤。NaOH溶液洗涤的作用是
。
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是
。
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为 ,要进一步提纯下列操作中必须的是 (填入正确选项前的字母)。
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是 (填人正确选项前的字母)。
A.25mL B.50mL C.250mL D.500mL
工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下: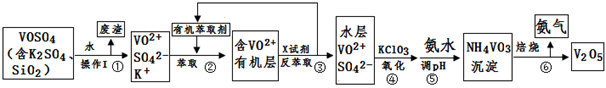
请回答下列问题:
(1)步骤①所得废渣的成分是 (写化学式),操作I的名称 。
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n (水层)+ 2nHA(有机层) 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是 。
③中X试剂为 。
(3)⑤的离子方程式为 。
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为 ;若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< 。〖已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39〗
(5)该工艺流程中,可以循环利用的物质有 和 。
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是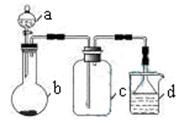
| 选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
| A | 浓氨水 | CaO | NH3 | H2O |
| B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
| C | 稀硝酸 | Cu | NO2 | H2O |
| D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |