题目内容
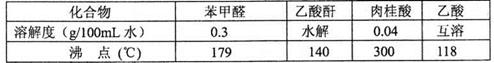
下面是提纯大理石(主要杂质是氧化铁)的流程图:
按要求回答下列问题:
(1)在工业生产中,将块状大理石磨成粉末,并在反应池中安装搅拌机。目的是________。
(2)操作Ⅱ中A物质最好应选择___________(填化学式),在该过程中要随时测定pH,在实验室中用pH试纸测定溶液pH的操作是______________________________。
(3)检验Fe3+已完全生成Fe(OH)3沉淀的方法是________________________________。
(4)由滤液B得到晶体B,操作过程包括___________(填操作名称)、冷却结晶。
(5)某化学小组在实验中用浓硝酸和铜反应制取二氧化氮并探究二氧化氮是否能支持木炭的燃烧,其实验装置图如下: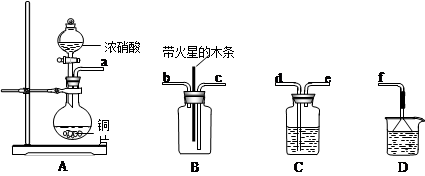
①按气流方向连接各仪器接口,顺序为a→______→______→______→______→f。装置C、装置D 的作用分别是__________________、__________________。
②实验开始后,能证明二氧化氮支持燃烧的实验现象是_______________________。
③已知二氧化氮和碳反应生成两种物质的量比为1:1有毒气体,则该反应的化学方程式为:___________________________。
(14分)(1)使固体快速溶解。(1分)(有其他合理答案也可得分)。
(2)NH3(或NH3·H2O)(1分);取一小块pH试纸放在玻璃片上,用玻璃棒沾取少量溶液点在pH试纸中部,变色后和比色卡对比,读出pH。(2分,答出三个要点得2分,答出2要点得1分)
(3)取上层清液(或滤液),滴加几滴KSCN溶液,如果溶液颜色不变,则说明Fe3+沉淀完全,如果变红,则说明没有沉淀完全。(2分,答出三个要点得2分,答出两个要点得1分)(有其他合理答案也可得分)。
(4)由于是硝酸铵溶液采用蒸发浓缩方法使其结晶析出,切忌不可温度过高,易分解。
(5)①d→e→c→b(2分);干燥气体(1分);吸收尾气(1分)。
②带火星的木条燃烧(1分)。
③NO2+C CO+NO(2分)
CO+NO(2分)
解析试题分析:
(1)将块状大理石磨成粉末,目的是增大固体接触面积,使固体快速溶解。凡是从这个角度答题都可以得分。
(2)通入NH3(或加入NH3·H2O)在后面步骤中便于分离,同时得到铵盐硝酸铵是一种重要的氮肥可以回收利用;pH试纸使用时要注意规范操作:放取一小块pH试纸放在玻璃片上,用玻璃棒沾取少量溶液点在pH试纸中部,变色后和比色卡对比,读出pH。
(3)由于Fe3+浓度较小,所以最后选择非常灵敏的检测方法,用KSCN溶液法,具体操作为:取上层清液(或滤液),滴加几滴KSCN溶液,如果溶液颜色不变,则说明Fe3+沉淀完全,如果变红,则说明没有沉淀完全。
(4)蒸发浓缩(1分)
(5)①从实验的目的来考虑,首先是发生装置,其次是净化,然后是检验,最后是尾气处理,所以连接顺序为d→e→c→b;装置C、装置D的作用分别是_干燥气体和吸收尾气。
②能证明二氧化氮支持燃烧应和初中所学的检测氧气支持燃烧的实验操作一样,可用带火星的木条燃烧。
③二氧化氮和碳反应生成两种物质的量比为1:1有毒气体,根据存在元素氮生成的是NO ,碳生成的是CO ,故反应为NO2+C CO+NO。
CO+NO。
考点:考查影响化学反应速率的外界因素和PH试纸的使用,实验室制处理和。

草酸亚铁(FeC2O4?2H2O)用作分析试剂及显影剂和新型电池材料磷酸亚铁锂的生产。已知:CO能与氯化钯(PdCl2)溶液反应生成黑色的钯粉。回答下列问题:
I.兴趣小组对草酸亚铁的分解产物进行实验和探究。
(1)将气体产物依次通过A、澄清石灰水,B、氯化钯,观察到A中澄清石灰水都变浑浊,B中出现黑色物质生成,则上述现象说明气体产物中有 。
(2)探究分解得到的固体产物中铁元素的存在形式。
①提出假设
假设1:________; 假设2:FeO; 假设3:FeO和Fe混合物
②设计实验方案证明假设3。
限选试剂: 1.0 mol?L-1盐酸、3% H2O2、0.1 mol?L-1CuSO4、20% KSCN、蒸馏水。
| 实验步骤 | 现象与结论 |
| 步骤1 :向试管中加入少量固体产物,再加入足量_________________,充分振荡 | 若溶液颜色明显改变,且有_______生成,则证明有铁单质存在 |
| 步骤2: 将步骤1中得到的浊液过滤,并用蒸馏水洗涤至洗涤液无色 | |
| 步骤3:取步骤2得到的少量固体与试管中, 滴加___________________________________ _______________________________________ | __________________________________ ___________________________________ |
II.某草酸亚铁样品中含有少量草酸(为方便于计算,草酸亚铁中草酸根和草酸分子均用C2O42-代替)。现用滴定法测定该样品中FeC2O4的含量。滴定反应分别是:5Fe2++MnO4-+8H+=5Fe3+ +Mn2++4H2O、5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O。
(3)实验方案设计为:
①将准确称量的0.20g草酸亚铁样品置于250 mL锥形瓶内,加入适量2 mol/L的H2SO4溶液,使样品溶解,加热至70℃左右,立即用浓度为0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记录数据。重复滴定2次。平均消耗V1 mL。
②向上述滴定混合液中加入适量的Zn粉和过量的2 mol/L的H2SO4溶液,煮沸5~8min,用KSCN溶液在点滴板上检验点滴液,直至溶液不立刻变红。将滤液过滤至另一个锥形瓶中,继续用0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记录数据。重复滴定2次。平均消耗V2 mL。
③若某小组的一次测定数据记录如下: V1= 18.90mL,V2=6.20mL。根据数据计算0.20g样品中:n(Fe2+)= ; n(C2O42-)= ;FeC2O4的质量分数为 (精确到0.01%,FeC2O4的式量为144)
用如图所示装置制取表格中的四种干燥、纯净的气体(必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。其中正确的是 ( )。
| 选项 | 气体 | a | b | c | d |
| A | SO2 | 浓硫酸 | Cu | H2O | 浓硫酸 |
| B | Cl2 | 浓盐酸 | MnO2 | NaOH溶液 | 浓硫酸 |
| C | NH3 | 饱和NH4Cl溶液 | 消石灰 | 空集气瓶 | 固体NaOH |
| D | NO | 稀硝酸 | 铜屑 | H2O | 浓硫酸 |






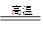 2NaVO3+2NaAlO2+2CO2↑
2NaVO3+2NaAlO2+2CO2↑