题目内容
草酸亚铁晶体(FeC2O4·2H2O)呈淡黄色。某课题组为探究草酸业铁晶体的化学性质, 进行了一系列实验探究。
(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到二氧化碳气体生成。这说明草酸亚铁晶体具有 (填“氧化性”、“还原性”或“碱性”)。若反应中消耗1 mol FeC2O4·2H2O,则参加反应的KMnO4为 mol。
(2)资料表明:在密闭容器中加热到一定温度时,草酸亚铁晶体可完全分解,生成几种氧化物,残留物为黑色固体。课题组根据课本上所介绍的铁的氧化物的性质,对黑色固体的组成提出如下假设,请你完成假设二和假设三:
假设一:全部是FeO
假设二:
假设三:
(3)为验证上述假设一是否成立,课题组进行如下研究。
【定性研究】请你完成下表中内容。
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 取少量黑色固体, | |
【定量研究】课题组在文献中查阅到,FeC2O4·2H2O受热分解时,固体质量随温度变化的曲线如下图所示,写出加热到400℃时,FeC2O4·2H2O晶体受热分解的化学方程式为: 。
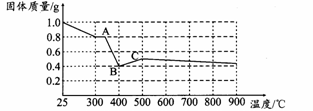
根据图象,如有1.0 g草酸亚铁晶体在坩埚中敞口充分加热,最终残留黑色固体的质量大于0.4 g。某同学由此得出结论:假设一不成立。你是否同意该同学的结论,并简述理由:
(共1 5分)
(1)还原性(1分) 0.6(2分)
(2)假设二:全部是Fe3O4(1分) 假设三:是FeO和Fe3O4的混合物(1分)
(3)【定性研究】(每空2分)
实验步骤:取少量黑色固体,加入适量稀盐酸(或稀硫酸)溶解,在溶液中加入KSCN溶液
预期实验现象和结论:若溶液不变红色,则假设一成立;若溶液变红色,则假设一不成立
【定量研究】
FeC2O4·2H2OFeO+CO↑+CO2↑+2H2O(或FeC2O4FeO+CO↑+CO2↑,3分)
不同意(1分),实验未在密闭容器中进行,FeO会被空气中的氧气进一步氧化,生成铁的其他氧化物(2分)
解析试题分析:
(1)高锰酸钾溶液的紫红色褪去,溶液变为棕黄色,很显然是FeC2O4被高锰酸钾氧化为Fe3+的结果,表明FeC2O4具有还原性。分析有关元素化合价的变化可知,反应过程中1 mol FeC2O4·2H2O可失去3 mol电子,而l mol KMnO4可得到5 mol电子:根据得失电子数相等的原则,反应中FeC2O4·2H2O与KMnO4的物质的量之比为5:3。因此,若反应中消耗1 mol FeC2O4·2H2O,则参加反应的KMnO4为3/5 mol。
(2)铁的氧化物中,呈黑色的有FeO和Fe3O4。
(3)【定性研究】FeO与盐酸或硫酸反应生成Fe2+,Fe2+与KSCN不反应。但Fe3O4或FeO和Fe3O4的混合物溶于稀盐酸或稀硫酸中生成Fe3+,遇KSCN变红色。据此即可设计方案进行验证。
【定量研究】草酸亚铁品体受热首先失去结品水,得到FeC2O4(即A点对应物质)。400℃时固体质量减少,应该是FeC2O4发生分解,牛成铁的氧化物(即B点对应物质)。根据图象可知1.0 g晶体分解生成的铁的氧化物的质量为0.4 g。设此铁的氧化物的化学式为FeaOb,根据Fe守恒可知0.4 g此氧化物中铁元素的质量为1.0 g×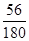 ,氧元素的质量为(0.4g—1.0 g×
,氧元素的质量为(0.4g—1.0 g×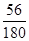 )g,故a:b="(1.0" g×
)g,故a:b="(1.0" g×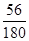 ):(0.4g—1.0 g×
):(0.4g—1.0 g×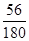 ),解得a:b=1:1,即晶体分解所得铁的氧化物为FeO。至此不难写出草酸亚铁晶体分解的化学方程式为:FeC2O4·2H2OFeO+CO↑+CO2↑+2H2O(或FeC2O4FeO+CO↑+CO2↑)。此后,残留固体的质量逐渐增大,显然是被空气中的氧气所氧化,生成了铁的其他氧化物。由于坩埚是敞口容器,FeO会被空气中的氧气进一步氧化生成铁的其他氧化物,根据图象可知固体质量肯定会大于4.0 g。
),解得a:b=1:1,即晶体分解所得铁的氧化物为FeO。至此不难写出草酸亚铁晶体分解的化学方程式为:FeC2O4·2H2OFeO+CO↑+CO2↑+2H2O(或FeC2O4FeO+CO↑+CO2↑)。此后,残留固体的质量逐渐增大,显然是被空气中的氧气所氧化,生成了铁的其他氧化物。由于坩埚是敞口容器,FeO会被空气中的氧气进一步氧化生成铁的其他氧化物,根据图象可知固体质量肯定会大于4.0 g。
考点:本题以探究实验为基础,考查了氧化还原反应、探究基本方法、物质的检验、化学计算等相关知识。

海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子形式存在。实验室从海藻中提取碘的流程如下: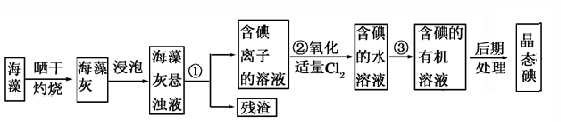
(1)指出提取碘的过程中有关实验操作的名称:
①为 ,③为 ;过程②中有关反应的离子方程式是 。
(2)提取碘的过程中可供选择的有机溶剂是( )
| A.甲苯、酒精 | B.四氯化碳、苯 | C.汽油、乙酸 | D.汽油、甘油 |
(4)从含碘的有机溶剂中提取碘和回收有机溶剂,还需要经过蒸馏。指出下图所示的实验装置中的错误之处: ① ,② 。
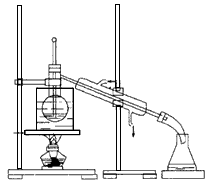
(5)进行上述蒸馏操作时,使用水浴加热的原因是 ,最后晶态碘在 里聚集。
达州市渠县境内含有丰富的深层地下食盐资源,食盐是日常生活中的必需品,也是重要的化工原料。
(1)经测定该县深层地下粗盐中含有少量K+、Ca2+、Mg2+、Fe3+等杂质离子,某研究性学习小组在实验室提纯NaCl的流程如下: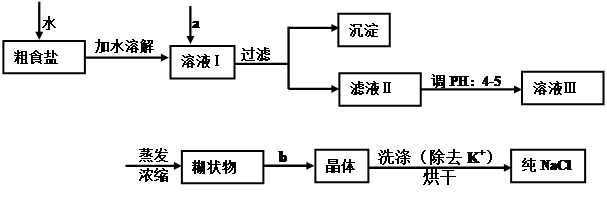
所提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇溶液、CCl4,仪器及用品自选。
①欲除去溶液中的Ca2+、Mg2+、Fe3+、SO42-,选出a操作中所代表的试剂,按滴加顺序依次为
(只填化学式),b步操作的名称是 。
②洗涤除去NaCl晶体表面附带的少量KCl,应选用试剂是 ,用PH试纸测定滤液ⅡPH值的方法是 。
(2)用提纯的NaCl配制500mL,2.5mol·L-1的NaCl溶液,所需仪器除烧杯,托盘天平(砝码和镊子),药匙,玻璃棒外,还需要 (填仪器名称),应称取NaCl g
(3)下列操作会导致所配NaCl溶液浓度偏高的是
| A.定容完毕后,盖塞,摇匀,再将容量瓶置于实验台上,发现液面低于刻度线,再添加蒸馏水至刻度线。 | |
| B.未将洗涤烧杯内壁的溶液转入容量瓶。 | C.定容时,俯视刻度线。 |
| D.转移溶液之前,容量瓶内有少量蒸馏水。 E、称量时,天平指针指向左盘。 |
草酸亚铁(FeC2O4?2H2O)用作分析试剂及显影剂和新型电池材料磷酸亚铁锂的生产。已知:CO能与氯化钯(PdCl2)溶液反应生成黑色的钯粉。回答下列问题:
I.兴趣小组对草酸亚铁的分解产物进行实验和探究。
(1)将气体产物依次通过A、澄清石灰水,B、氯化钯,观察到A中澄清石灰水都变浑浊,B中出现黑色物质生成,则上述现象说明气体产物中有 。
(2)探究分解得到的固体产物中铁元素的存在形式。
①提出假设
假设1:________; 假设2:FeO; 假设3:FeO和Fe混合物
②设计实验方案证明假设3。
限选试剂: 1.0 mol?L-1盐酸、3% H2O2、0.1 mol?L-1CuSO4、20% KSCN、蒸馏水。
| 实验步骤 | 现象与结论 |
| 步骤1 :向试管中加入少量固体产物,再加入足量_________________,充分振荡 | 若溶液颜色明显改变,且有_______生成,则证明有铁单质存在 |
| 步骤2: 将步骤1中得到的浊液过滤,并用蒸馏水洗涤至洗涤液无色 | |
| 步骤3:取步骤2得到的少量固体与试管中, 滴加___________________________________ _______________________________________ | __________________________________ ___________________________________ |
II.某草酸亚铁样品中含有少量草酸(为方便于计算,草酸亚铁中草酸根和草酸分子均用C2O42-代替)。现用滴定法测定该样品中FeC2O4的含量。滴定反应分别是:5Fe2++MnO4-+8H+=5Fe3+ +Mn2++4H2O、5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O。
(3)实验方案设计为:
①将准确称量的0.20g草酸亚铁样品置于250 mL锥形瓶内,加入适量2 mol/L的H2SO4溶液,使样品溶解,加热至70℃左右,立即用浓度为0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记录数据。重复滴定2次。平均消耗V1 mL。
②向上述滴定混合液中加入适量的Zn粉和过量的2 mol/L的H2SO4溶液,煮沸5~8min,用KSCN溶液在点滴板上检验点滴液,直至溶液不立刻变红。将滤液过滤至另一个锥形瓶中,继续用0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记录数据。重复滴定2次。平均消耗V2 mL。
③若某小组的一次测定数据记录如下: V1= 18.90mL,V2=6.20mL。根据数据计算0.20g样品中:n(Fe2+)= ; n(C2O42-)= ;FeC2O4的质量分数为 (精确到0.01%,FeC2O4的式量为144)
下列气体中,既可用浓硫酸干燥,又可用碱石灰干燥的是( )
| A.Cl2 | B.O2 | C.SO2 | D.NH3 |