题目内容
工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下: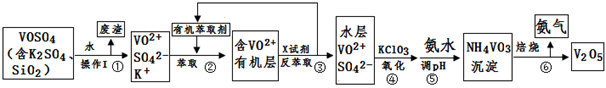
请回答下列问题:
(1)步骤①所得废渣的成分是 (写化学式),操作I的名称 。
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n (水层)+ 2nHA(有机层) 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是 。
③中X试剂为 。
(3)⑤的离子方程式为 。
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为 ;若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< 。〖已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39〗
(5)该工艺流程中,可以循环利用的物质有 和 。
(16分)
(1)SiO2(写名称0分)(2分);过滤(2分)
(2)加入碱中和硫酸,促使平衡正向移动,提高钒的萃取率[或类似表述,如提高RAn(有机层)的浓度、百分含量、充分溶解等](2分);H2SO4(2分)(写稀硫酸、浓硫酸也给分)
(3)NH3·H2O+VO3- =NH4VO3↓+OH-或NH3·H2O+VO3-+H+ =NH4VO3↓+ H2O或分2步:NH3·H2O+H+ = NH4++H2O,NH4++VO3- =NH4VO3↓(2分)(不写↓扣1分)
(4)1.7~1.8(或1.7、1.8其中一个)(2分),2.6×10-3mol·L-1(2分)(数值1分、单位1分)
(5)氨气(或氨水或NH3或NH3·H2O)(1分);有机萃取剂(HA或有机溶剂或萃取后的有机层也给分)(1分)(2空之间无顺序要求)
解析试题分析:(1)对比操作I前后的物质,可以判断VOSO4、K2SO4是易溶易电离的盐,而二氧化硅是难溶于水的酸性氧化物,因此滤渣的主要成分是SiO2;操作I的目的是从混合物中分离滤渣和溶液,说明I是过滤;(2)加入碱,碱能中和硫酸,减小硫酸浓度,使R2(SO4)n (水层)+ 2nHA(有机层) 2RAn(有机层)+ nH2SO4 (水层)的平衡向正反应方向移动,提高钒的萃取率[或类似表述,如提高RAn(有机层)的浓度、百分含量、充分溶解等];加入X试剂的目的是得到有机萃取剂HA,因此需要使R2(SO4)n (水层)+ 2nHA(有机层)
2RAn(有机层)+ nH2SO4 (水层)的平衡向正反应方向移动,提高钒的萃取率[或类似表述,如提高RAn(有机层)的浓度、百分含量、充分溶解等];加入X试剂的目的是得到有机萃取剂HA,因此需要使R2(SO4)n (水层)+ 2nHA(有机层) 2RAn(有机层)+ nH2SO4 (水层)的平衡向逆反应方向移动,且不能引入新的杂质,因此X为硫酸;(3)加入氨水提高溶液的pH至1.7~1.8之间时,首先氨水与酸中和生成铵根离子,接着铵根离子与钒酸根离子结合生成钒酸铵沉淀,即NH3·H2O+H+ = NH4++H2O,NH4++VO3- =NH4VO3↓或NH3·H2O+VO3- =NH4VO3↓+OH-或NH3·H2O+VO3-+H+ =NH4VO3↓+ H2O;(4)读表,pH至1.7~1.8之间时,钒沉淀率最高,达到98.8%;根据钒沉淀率和溶液pH之间关系,若钒沉淀率为93.1%,则溶液pH=2.0,则c(H+)=10—2mol/L,由于常温下水的离子积为1.0×10—14,c(OH-)=Kw/ c(H+)=10—12mol/L,若不产生Fe(OH)3沉淀,则Qc<Ksp,则c(Fe3+)?c3 (OH-)< 2.6×10-39,则c(Fe3+)< 2.6×10-3mol/L;(5)图中萃取步骤消耗有机萃取剂,反萃取步骤生成有机萃取剂,因此有机萃取剂HA可以循环利用;图中调pH需要消耗氨水,焙烧时生成氨气,为了防止污染环境,氨气回收变为氨水,因此氨气或氨水可以循环利用。
2RAn(有机层)+ nH2SO4 (水层)的平衡向逆反应方向移动,且不能引入新的杂质,因此X为硫酸;(3)加入氨水提高溶液的pH至1.7~1.8之间时,首先氨水与酸中和生成铵根离子,接着铵根离子与钒酸根离子结合生成钒酸铵沉淀,即NH3·H2O+H+ = NH4++H2O,NH4++VO3- =NH4VO3↓或NH3·H2O+VO3- =NH4VO3↓+OH-或NH3·H2O+VO3-+H+ =NH4VO3↓+ H2O;(4)读表,pH至1.7~1.8之间时,钒沉淀率最高,达到98.8%;根据钒沉淀率和溶液pH之间关系,若钒沉淀率为93.1%,则溶液pH=2.0,则c(H+)=10—2mol/L,由于常温下水的离子积为1.0×10—14,c(OH-)=Kw/ c(H+)=10—12mol/L,若不产生Fe(OH)3沉淀,则Qc<Ksp,则c(Fe3+)?c3 (OH-)< 2.6×10-39,则c(Fe3+)< 2.6×10-3mol/L;(5)图中萃取步骤消耗有机萃取剂,反萃取步骤生成有机萃取剂,因此有机萃取剂HA可以循环利用;图中调pH需要消耗氨水,焙烧时生成氨气,为了防止污染环境,氨气回收变为氨水,因此氨气或氨水可以循环利用。
考点:考查物质制备化学工艺流程,涉及滤渣成分推断、混合物分离提纯方法、根据平衡移动原理解释加碱或加酸的原因、关键步骤的离子方程式、生成沉淀控制溶液pH的范围、溶度积的有关计算、循环利用的物质推断等。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案草酸亚铁(FeC2O4?2H2O)用作分析试剂及显影剂和新型电池材料磷酸亚铁锂的生产。已知:CO能与氯化钯(PdCl2)溶液反应生成黑色的钯粉。回答下列问题:
I.兴趣小组对草酸亚铁的分解产物进行实验和探究。
(1)将气体产物依次通过A、澄清石灰水,B、氯化钯,观察到A中澄清石灰水都变浑浊,B中出现黑色物质生成,则上述现象说明气体产物中有 。
(2)探究分解得到的固体产物中铁元素的存在形式。
①提出假设
假设1:________; 假设2:FeO; 假设3:FeO和Fe混合物
②设计实验方案证明假设3。
限选试剂: 1.0 mol?L-1盐酸、3% H2O2、0.1 mol?L-1CuSO4、20% KSCN、蒸馏水。
| 实验步骤 | 现象与结论 |
| 步骤1 :向试管中加入少量固体产物,再加入足量_________________,充分振荡 | 若溶液颜色明显改变,且有_______生成,则证明有铁单质存在 |
| 步骤2: 将步骤1中得到的浊液过滤,并用蒸馏水洗涤至洗涤液无色 | |
| 步骤3:取步骤2得到的少量固体与试管中, 滴加___________________________________ _______________________________________ | __________________________________ ___________________________________ |
II.某草酸亚铁样品中含有少量草酸(为方便于计算,草酸亚铁中草酸根和草酸分子均用C2O42-代替)。现用滴定法测定该样品中FeC2O4的含量。滴定反应分别是:5Fe2++MnO4-+8H+=5Fe3+ +Mn2++4H2O、5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O。
(3)实验方案设计为:
①将准确称量的0.20g草酸亚铁样品置于250 mL锥形瓶内,加入适量2 mol/L的H2SO4溶液,使样品溶解,加热至70℃左右,立即用浓度为0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记录数据。重复滴定2次。平均消耗V1 mL。
②向上述滴定混合液中加入适量的Zn粉和过量的2 mol/L的H2SO4溶液,煮沸5~8min,用KSCN溶液在点滴板上检验点滴液,直至溶液不立刻变红。将滤液过滤至另一个锥形瓶中,继续用0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记录数据。重复滴定2次。平均消耗V2 mL。
③若某小组的一次测定数据记录如下: V1= 18.90mL,V2=6.20mL。根据数据计算0.20g样品中:n(Fe2+)= ; n(C2O42-)= ;FeC2O4的质量分数为 (精确到0.01%,FeC2O4的式量为144)
某矿样含有大量的CuS、少量铁的氧化物及少量其它不溶于酸的杂质。某化学课外小组设计以下流程,取该矿样为原料生产CuC12·2H2O晶体。
已知:常温下,金属离子开始沉淀和沉淀完全时的pH见下表。
| 金属离子 | 氢氧化物开始沉淀的pH | 氢氧化物沉淀完全的pH |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
回答下列问题:
(1)步骤①的焙烧过程中需要通入氧气。在实验室中,可使用常见化学物质利用右图所示装置制取氧气,试写出熟悉的符合上述条件的两个化学方程式:______、______

(2)培烧产生的尾气中含有的一种气体是形成酸雨的污染物,若将尾气通入氨水中,能发生多个反应,写出其中可能发生的两个氧化还原反应的化学方程式:______、______
(3)步骤②酸浸过程中,需要用到3mol·L-1的盐酸100mL,配制该盐酸溶液时,除了用到烧杯、玻璃棒、胶头滴管外,还需要的仪器有_________
(4)步骤④加入物质X的目的是_____,物质X可以选用下列物质中的_____。
A.氢氧化钠 B.稀盐酸 C.氨水 D.氧化铜
(5)当溶液中金属离子浓度低于1×10-5 mol·L-1时,认为该金属离子沉淀完全,则Ksp[Fe(OH)2]= _____。
下列气体中,既可用浓硫酸干燥,又可用碱石灰干燥的是( )
| A.Cl2 | B.O2 | C.SO2 | D.NH3 |


 2NaVO3+2NaAlO2+2CO2↑
2NaVO3+2NaAlO2+2CO2↑