题目内容
2.某主族元素的最高价含氧酸的阴离子的符号是RO3-,则该元素的气态氢化物的化学式是( )| A. | HR | B. | H2R | C. | RH3 | D. | RH4 |
分析 化合物中元素的化合价代数和为零,据此计算R元素的化合价.再利用最高正化合价+|最低负化合价|=8,计算R元素在气态氢化物中的化合价,可确定氢化物化学式.
解答 解:元素R的最高价含氧酸的阴离子是RO3-,可知R的最高正价为+5价,则最低负化合价为5-8=-3,所以氢化物的化学式应为RH3.
故选C.
点评 本题考查化合物中元素化合价的计算,难度不大,清楚化合物中元素的化合价代数和为零是关键,掌握识记常见元素的化合价.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
16.化学与能源开发、环境保护、资源利用等密切相关.下列说法正确的是( )
| A. | 为提高农作物的产量和质量,应大量使用化肥和农药 | |
| B. | 实现化石燃料清洁利用,就无需开发新能源 | |
| C. | 废旧电池必须集中处理,以防止重金属污染 | |
| D. | 绿色化学的核心是应用化学原理对环境污染进行治理 |
10.化学与生产、生活密切相关,下列说法中正确的是( )
| A. | 高纯度的硅单质广泛用于制作光导纤维 | |
| B. | 在汽车排气管上加装尾气“催化转化器”可以有效减少有害气体的排放 | |
| C. | 气象环境报告中新增的“PM2.5”是对一种新分子的描述 | |
| D. | 为防止食品氧化变质,食品袋中放有硅胶包 |
17.对于平衡体系:aA(g)+bB(g)?cC(s)+dD(g);△H<0,有下列判断,其中不正确的是( )
| A. | 若容器容积不变,升高温度,各气体的相对分子质量一定增大 | |
| B. | 若从正反应开始,平衡时A、B的转化率相等,则A、B的物质的量之比为a:b | |
| C. | 达到平衡时,有amol A消耗的同时有b mol B生成 | |
| D. | 若容器为体积不变的密闭容器且a+b=c+d,则当升高容器内温度时平衡向左移动,容器中气体的压强增大 |
7.下列有关金属的冶炼说法正确的是( )
| A. | 高炉炼铁的过程是通过置换反应得到铁 | |
| B. | 用直接加热氧化铝的方法冶炼得到铝 | |
| C. | 高温加热氧化镁和碳的混合物可以制单质镁 | |
| D. | 硫化亚铜与氧气反应炼铜的过程不属于氧化还原反应 |
14.人造地球卫星用到的一种高能电池--银锌蓄电池,其电池的电极反应式为:Zn+2OH--2e-═ZnO+H2↑,Ag2O+H2O+2e═2Ag+2OH-.据此判断正确的是( )
| A. | Zn负极,并被还原 | B. | Ag2O正极,并被还原 | ||
| C. | 电解质溶液为碱性 | D. | Zn正极,并被氧化 |
12.下列实验现象预测正确的是( )
| A. | 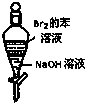 如图实验:振荡后静置,上层溶液颜色保持不变 如图实验:振荡后静置,上层溶液颜色保持不变 | |
| B. | 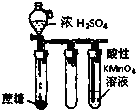 如图实验:酸性KMnO4溶液中出现气泡,且颜色逐渐褪去 如图实验:酸性KMnO4溶液中出现气泡,且颜色逐渐褪去 | |
| C. | 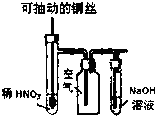 如图实验Ⅲ:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 如图实验Ⅲ:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 | |
| D. | 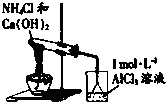 如图实验IV:烧杯中先出现白色沉淀,后溶解 如图实验IV:烧杯中先出现白色沉淀,后溶解 |
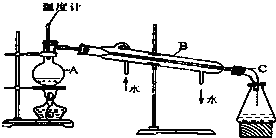 如图是某学生绘制的实验室蒸馏石油的装置图:
如图是某学生绘制的实验室蒸馏石油的装置图: (Ⅰ)开发新型替代燃料成为各国关注的重要科研项目,中国现已成为世界第三大利用植物秸秆(主要成分纤维素)生产燃料乙醇的国家.写出乙醇燃烧的化学方程式:C2H5OH+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+3H2O.
(Ⅰ)开发新型替代燃料成为各国关注的重要科研项目,中国现已成为世界第三大利用植物秸秆(主要成分纤维素)生产燃料乙醇的国家.写出乙醇燃烧的化学方程式:C2H5OH+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+3H2O.