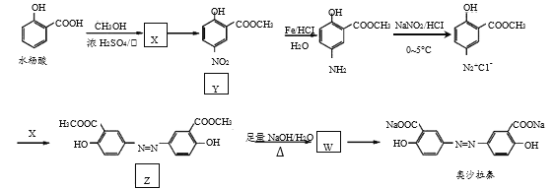
题目内容
【题目】用NA表示阿伏加德罗常数的数值,下列说法正确的是
A.2.1g丙烯中所含的共用电子对总数为0.3NA
B.在高温高压、催化剂的条件下,56gN2和12gH2充分反应,生成NH3的分子数为4NA
C.过氧化氢分解制得标准状况下2.24LO2,转移电子数目为0.4NA
D.5.6 g乙烯和环丙烷的混合物中含C—H键数目为0.8NA
【答案】D
【解析】
A.丙烯的结构式为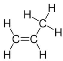 ,一个丙烯分子中有9对共用电子对;2.1g丙烯的物质的量为0.05mol,总共含有0.05mol×9=0.45mol共用电子对,所含的共用电子对总数为0.45NA,故A错误;
,一个丙烯分子中有9对共用电子对;2.1g丙烯的物质的量为0.05mol,总共含有0.05mol×9=0.45mol共用电子对,所含的共用电子对总数为0.45NA,故A错误;
B.56gN2的物质的量为2mol,12gH2的物质的量为6mol,但氮气和氢气的反应可逆反应,反应物无法全部转化为生成物,所以生成NH3小于4mol,故B错误;
C.过氧化氢分解产生氧气时,氧气为唯一氧化产物,O元素化合价由-1价变为0价,标况下2.24L氧气的物质的量为0.1mol,转移电子为0.1mol×2=0.2mol,故C错误;
D.乙烯的结构式为![]() ,环丙烷的结构式为
,环丙烷的结构式为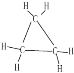 ,乙烯与环丙烷具有相同最简式CH2,所以5.6g乙烯和环丙烷的混合物中含C-H键数目为:
,乙烯与环丙烷具有相同最简式CH2,所以5.6g乙烯和环丙烷的混合物中含C-H键数目为:![]() ×2×NA=0.8NA,故D正确;
×2×NA=0.8NA,故D正确;
综上所述答案为D。

 阅读快车系列答案
阅读快车系列答案【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料Mg0:MgSO4(s)+CO(g) ![]() MgO(s)+CO2(g)+SO2(g)△H>0 该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s)+CO2(g)+SO2(g)△H>0 该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是

选项 | x | y |
A | 压强 | CO2与CO的物质的量之比 |
B | 温度 | 容器内混合气体的密度 |
C | MgSO4的质量(忽略体积) | CO的转化率 |
D | SO2的浓度 | 平衡常数K |
A. A B. B C. C D. D
【题目】一定温度下,在三个体积均为0.5 L的恒容密闭容器中发生反应:CO(g)+Cl2(g)![]() COCl2(g),其中容器Ⅰ中反应在5 min时达到平衡状态。
COCl2(g),其中容器Ⅰ中反应在5 min时达到平衡状态。
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
CO | Cl2 | COCl2 | COCl2 | ||
Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
Ⅱ | 500 | 1.0 | a | 0 | 0.5 |
Ⅲ | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
下列说法中正确的是
A. 容器Ⅰ中前5 min的平均反应速率v(CO)=0.16 mol·L-1·min-1
B. 该反应正反应为吸热反应
C. 容器Ⅱ中起始时Cl2的物质的量为0.55 mol
D. 若起始时向容器Ⅰ加入CO0.8mol、Cl20.8mol,达到平衡时CO转化率大于80%