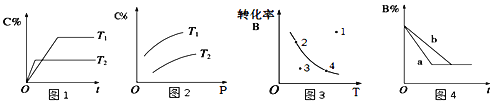
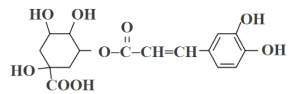题目内容
【题目】铝是一种轻金属,被称为金属界的“万金油”,应用范围极其广阔,含铝的化合物如氧化铝、氢氧化铝等在工业上用途十分广泛。
(1)写出金属铝与NaOH反应的化学方程式,并标出电子转移数目和方向: _______________________________________________________________________。
将一滴汞滴在已除去表面氧化膜的铝片上,放置在空气中等待片刻,滴在汞的地方会较快地长出“白毛”,其成分为_______________。
a. Al2O3 b . Al(OH)3 c. HgO d.铝汞齐
(2)某兴趣小组尝试分离Fe2O3和Al2O3的混合物,流程图,写出下列操作的名称及物质的化学式:
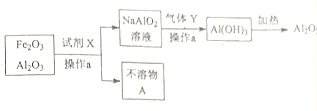
操作a的名称为_____________;
试剂X__________;不溶物A__________;
气体Y__________;
(3)写出Al(OH)3的电离方程式____________________________________________。实验室通常用AlCl3溶液作为制备Al(OH)3的原料,写出在![]() 溶液中滴加过量NaOH溶液的化学方程式:_________________________________________________。
溶液中滴加过量NaOH溶液的化学方程式:_________________________________________________。
(4)在100mL 2mol/L AlCl3溶液中滴加NaOH溶液,过滤、洗涤、烘干后得到7.8g Al(OH)3沉淀,则加入的NaOH的物质的量为__________mol。
(5)氢氧化铝是应用广泛的无机阻燃添加剂,阻燃时发生的化学反应为:2 Al(OH)3 ![]() Al2O3+3H2O根据方程式解释氢氧化铝能做阻燃剂的原因:_______________________________________________________________________。
Al2O3+3H2O根据方程式解释氢氧化铝能做阻燃剂的原因:_______________________________________________________________________。
【答案】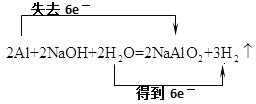 a 过滤 NaOH溶液 Fe2O3 CO2 H2O+AlO2-+H+
a 过滤 NaOH溶液 Fe2O3 CO2 H2O+AlO2-+H+![]() Al(OH)3
Al(OH)3![]() Al3++3OH- AlCl3+4NaOH=NaAlO2+3NaCl+2H2O 0.3mol或0.7mol Al(OH)3在高温下能分解出H2O,其他产物无毒,且此反应为吸热反应。
Al3++3OH- AlCl3+4NaOH=NaAlO2+3NaCl+2H2O 0.3mol或0.7mol Al(OH)3在高温下能分解出H2O,其他产物无毒,且此反应为吸热反应。
【解析】
(1)铝作还原剂,水作氧化剂,根据氧化还原反应的规律分析作答;根据铝的化学性质活泼分析;
(2)利用氧化铝与氧化铁不一样的化学性质分析;
(3)Al(OH)3为两性氢氧化物;![]() 溶液中滴加过量NaOH溶液会生成偏铝酸钠、氯化钠与水;
溶液中滴加过量NaOH溶液会生成偏铝酸钠、氯化钠与水;
(4)根据碱的用量是否能溶解沉淀氢氧化铝分类讨论;
(5)从分解反应的特点考虑。
(1)反应化学方程式为2A1+2NaOH+2H2O=2NaA1O2+3H2↑,Al失去电子,水中H得到电子,反应转移6e-,则电子转移的方向和数目为 ;
;
将一滴汞滴在已除去表面氧化膜的铝片上,放置在空气中等待片刻,滴有汞的地方会较快地长出“白毛”,这是因为铝汞齐的存在,这时的氧化铝不再是致密结构,生成疏松的白色氧化铝成毛刷状,铝化学性质比较活泼,易与氧气生成氧化铝,而汞化学性质不活泼,所以生成的白毛为氧化铝,化学式为Al2O3,答案选a;
(2) Fe2O3和Al2O3的混合物加入试剂X后通过操作a得到偏铝酸钠溶液和不溶物,则操作a为固液分离,名称为过滤;
氧化铝能与氢氧化钠溶液反应生成偏铝酸钠,故试剂X为NaOH溶液;Fe2O3不能与NaOH溶液反应,故不溶物A为Fe2O3;氢氧化铝能溶于强酸强碱,但不溶于弱酸,则偏铝酸钠可通入CO2反应产生Al(OH)3,故气体Y为CO2;
(3) Al(OH)3为两性氢氧化物,能发生酸式电离和碱式电离,电离方程式为H2O+AlO2-+H+![]() Al(OH)3
Al(OH)3![]() Al3++3OH-;
Al3++3OH-;
常用AlCl3溶液作为制备Al(OH)3的原料,在AlCl3溶液中滴加过量NaOH溶液反应生成偏铝酸钠、氯化钠和水,反应的化学方程式为:AlCl3+4NaOH=NaAlO2+3NaCl+2H2O;
(4) 100mL2mol/L AlCl3溶液中AlCl3的物质的量为0.1L×2mol/L=0.2mol;沉淀的质量是7.8g,其物质的量为 ![]() =0.1mol,
=0.1mol,
①若碱不足,由Al3++3OH-═Al(OH)3↓可知,
NaOH的物质的量为0.1mol×3=0.3mol;
②碱与铝离子的物质的量之比大于3:1,小于4:1,
则由 Al3++3OH-═Al(OH)3↓
0.2mol 0.6mol 0.2mol
Al(OH)3+OH-═AlO2-+2H2O
(0.2-0.1)mol 0.1mol
则消耗的碱的物质的量为0.6mol+0.1mol=0.7mol;
(5) Al(OH)3在高温下能分解出H2O,阻燃时发生的化学反应为:2 Al(OH)3 ![]() Al2O3+3H2O,其他产物无毒,且此反应为吸热反应,故氢氧化铝是应用广泛的无机阻燃添加剂。
Al2O3+3H2O,其他产物无毒,且此反应为吸热反应,故氢氧化铝是应用广泛的无机阻燃添加剂。

【题目】实验室制乙烯时,常因温度过高而发生副反应,使部分乙醇跟浓硫酸反应生成二氧化硫、二氧化碳、水蒸气和炭黑。
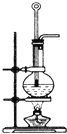
(1)写出实验室制取乙烯的化学方程式______________________________
编号 | ① | ② | ③ | ④ |
装置 |
|
|
|
|
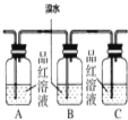
(2)请用表中编号为①、②、③、④的装置设计一个实验,以验证上述反应混合气体中含CO2、SO2和水蒸气.用装置的编号表示装置的连接顺序(按产物气流从左到右顺序): ___________________________.
(3)实验时装置①中A瓶的现象是________,B瓶溶液的作用是____________。B中的溴水能否用酸性KMnO4溶液代替,为什么?____________________。
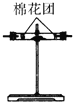
(4)装置③中加的固体药品是________,以验证混合气体中有_____________。装置②中盛的溶液是______________,以验证混合气体中的_________________。