题目内容
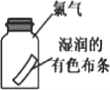
【题目】某化学学习小组用如下图所示装置制备、收集Cl2,并进行性质验证实验(夹持装置略去)。下列说法正确的是( )

A. 用![]() 和浓盐酸制备
和浓盐酸制备![]() 时,只选
时,只选![]()
B. ![]() 用于
用于![]() 收集时,a为进气口
收集时,a为进气口
C. ![]() 中加入NaBr溶液和
中加入NaBr溶液和![]() ,通入
,通入![]() 反应后振荡、静置,下层溶液呈橙红色
反应后振荡、静置,下层溶液呈橙红色
D. ![]() 中通入
中通入![]() 使品红溶液褪色后,取出溶液加热可恢复红色
使品红溶液褪色后,取出溶液加热可恢复红色
【答案】C
【解析】
A. KMnO4和浓盐酸制备Cl2为固液不加热型发生装置;
B. 氯气的密度比空气大;
C. 通入Cl2反应后生成易溶于CCl4的Br2;
D. 氯水具有漂白性,不可逆。
A. KMnO4和浓盐酸反应制备Cl2,①不可行,高锰酸钾可溶于水,氯气可以从长颈漏斗中逸出。选②可达到实验目的,故A项错误;
B. 排空气法收集氯气时,因氯气的密度比空气大,则应从b进气,故B项错误;
C. Cl2的氧化性比Br2大,通入NaBr溶液中,会发生氧化还原反应生成Br2,进而被CCl4萃取在下层溶液中,显橙红色,故C项正确;
D. Cl2能使品红溶液褪色,主要是发生了氧化还原反应,不可逆,因此取出溶液加热不能恢复红色,故D项错误;
答案选C。

 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案【题目】有A、B、C、D、E、F六种元素,它们的相关信息如下表:
元素代号 | 相关信息 |
A | 最外层的电子数是次外层电子数的3倍 |
B | 海水中含量第一位的金属元素 |
C | L层得1个电子后成为稳定结构 |
D | 二价阴离子核外有18个电子 |
E | 失去一个电子后就成为一个质子 |
F | 单质为黄绿色气体,具有刺激性气味 |
请填写下列空格:
(1)A原子的电子式:_____。
(2)B离子的结构示意图:_______。
(3)C元素的名称:___,C原子中能量最高的电子位于第______层,与C离子质子数与电子数均相同的微粒可能是______(用微粒符号表示)。
(4)D的二价阴离子的电子式:___,D元素的某种同位素原子质量数为34,该原子核内的中子数为_____。
(5)A、B、E三种元素形成的化合物常用于吸收F单质,反应的化学方程式:_____________。