题目内容
12.实验室里用下列仪器和药品制取纯净的无水氯化铜.根据要求填写下列空白:| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 仪器及装置图 |  | 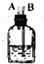 |  |  |  | 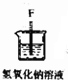 |
(2)装置⑥中发生反应的化学方程式是Cl2+2NaOH=NaCl+NaClO+H2O.
(3)实验开始时,应先点燃⑤(填装置序号)处的酒精灯,否则CuCl2中含有CuO(填化学式)杂质.待充分反应后,装置①的玻离管中剩余物呈棕黄色.冷却后,将制得的产物配成饱和溶液,溶液呈绿色.
(4)某小组推理反应结束后,⑤中一定有HCl剩余,请设计实验判断这一结论是否正确?加碳酸钠有气泡.
分析 用浓盐酸与二氧化锰反生成氯气,除杂后与铜反应生成氯化铜,尾气用氢氧化钠吸收,所以仪器连接顺序为:③⑤④②①⑥,反应生成的氯气中混有HCl,则②中饱和食盐水可除杂,在①中发生Cu+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$CuCl2,最后⑥中吸收尾气,发生Cl2+2NaOH=NaCl+NaClO+H2O,实验中注意氯气排出装置中的空气,以此来解答.
解答 解:制取纯净的无水氯化铜,仪器连接顺序为:③⑤④②①⑥,
(1)②在④左边时,则②中加入液体的名称是饱和食盐水,可除去HCl,故答案为:饱和食盐水;
(2)装置⑥中发生反应的化学方程式是Cl2+2NaOH=NaCl+NaClO+H2O,故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;
(3)制备氯化铜时,应先排出装置中的空气,则先点燃⑤处的酒精灯,否则CuCl2中含有CuO杂质.待充分反应后,装置①的玻离管中剩余物呈棕黄色.冷却后,将制得的产物配成饱和溶液,溶液呈绿色,
故答案为:⑤;CuO;棕黄;绿;
(4)反应结束后,⑤中一定有HCl剩余,则加碳酸钠有气泡,可说明这一结论,故答案为:加碳酸钠有气泡.
点评 本题考查物质的制备实验,为高频考点,把握氯气的制备、氯化铜的制备反应及实验装置的作用为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
2.同温同压下,m g气体A与n g气体B的分子数目相同,下列说法中不正确的是( )
| A. | 气体A与气体B的相对分子质量之比为m:n | |
| B. | 同质量的气体A与气体B,所含分子数目之比为n:m | |
| C. | 相同条件下,等体积的气体A与气体B的质量之比为m:n | |
| D. | 相同条件下,气体A与气体B的密度之比为n:m |
20.用铂丝做焰色反应实验时,每次做完后都要( )
| A. | 用水洗涤2~3次 | B. | 用滤纸擦干净 | ||
| C. | 先用盐酸洗,再用蒸馏水洗 | D. | 先用盐酸洗,再灼烧 |
7.依据:2Fe2++Cl2═2Fe3++2Cl-、2Fe3++Cu═2Fe2++Cu2+、Fe+Cu2+═Fe2++Cu,判断氧化性强弱顺序正确的是( )
| A. | Fe3+>Cl2>Fe2+>Cu2+ | B. | Cl2>Fe3+>Cu2+>Fe2+ | ||
| C. | Cl2>Fe3+>Fe2+>Cu2+ | D. | Fe3+>Cl2>Cu2+>Fe2+ |
17.在下述条件下,一定能大量共存的离子组是( )
| A. | 水电离出的c(H+)=10-12mol/L的溶液:Ba2+、Na+、NO3-、Cl- | |
| B. | 含有大量NO3-的水溶液中:NH4+、Fe2+、SO42-、H+ | |
| C. | 在pH=7的溶液中:Na+、Fe3+、SO42-、Br- | |
| D. | 强碱性溶液中:ClO-、S2-、HSO3-、Na+ |
4.NaHSO4在水溶液中能电离出H+、Na+、和SO42-,下列对于NaHSO4的分类不正确的是( )
| A. | NaHSO4是盐 | B. | NaHSO4是一元酸 | C. | NaHSO4是钠盐 | D. | NaHSO4是酸式盐 |