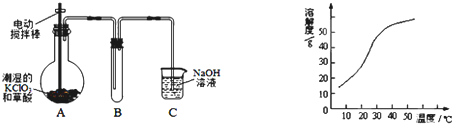
题目内容
10.五种短周期元素的某些性质如下表所示(其中只有W、Y、Z为同周期元素)| 元素代号 | X | W | Y | Z | Q |
| 原子半径(×10-12m) | 37 | 64 | 66 | 70 | 154 |
| 主要化合价 | +1 | -1 | -2 | +5、-3 | +1 |
| A. | 由Q与Y形成的化合物中可能存在共价键 | |
| B. | Z与X之间形成的化合物具有还原性 | |
| C. | 由X、Y、Z三种元素形成的化合物,其晶体可能是离子晶体 | |
| D. | Y与W形成的化合物中,Y显负价 |
分析 原子的电子层数越大,其原子半径越大,同一周期元素中,原子半径随着原子序数增大而减小,在短周期元素中,元素的最高正化合价与其族序数相等,最低负化合价=族序数-8,
根据表中数据知,X的原子半径最小,且其正化合价为+1,则X位于第IA族;W、Y、Z为同周期元素,根据其化合价知,W为第VIIA族、Y为第VIA族、Z为第VA族元素,Q为第IA族元素,其原子半径最大,且为短周期元素,所以Q是Na元素,W、Y、Z都属于第二周期元素,所以W是F元素、Y是O元素、Z是N元素,X原子半径小于W,所以X是H元素,结合元素周期率以及对应物质的性质解答该题.
解答 解:原子的电子层数越大,其原子半径越大,同一周期元素中,原子半径随着原子序数增大而减小,在短周期元素中,元素的最高正化合价与其族序数相等,最低负化合价=族序数-8,
根据表中数据知,X的原子半径最小,且其正化合价为+1,则X位于第IA族;W、Y、Z为同周期元素,根据其化合价知,W为第VIIA族、Y为第VIA族、Z为第VA族元素,Q为第IA族元素,其原子半径最大,且为短周期元素,所以Q是Na元素,W、Y、Z都属于第二周期元素,所以W是F元素、Y是O元素、Z是N元素,X原子半径小于W,所以X是H元素,
A.Y是O元素、Q是Na元素,二者能形成Na2O、Na2O2,Na2O中只存在离子键,Na2O2中存在离子键和共价键,故A正确;
B.Z与X之间形成的化合物是NH3,氨气中N元素处于最低价态,所以氨气具有还原性,故B正确;
C.由H、O、N三种元素形成的化合物,其晶体不一定是分子晶体,如硝酸铵为离子晶体,故C正确;
D.OF2中F元素显-1价、O元素显+2价,故D错误;
故选D.
点评 本题考查了原子结构和元素周期律的关系,根据元素的原子半径、化合价结合元素周期律来推断元素,正确推断元素是解本题关键,再结合物质的结构来分析解答,难度不大.

| A. | 华裔科学家高琨在光纤传输信息领域中取得突破性成就,光纤的主要成分是高纯度的二氧化硅 | |
| B. | 汽油、漂白粉、水玻璃、王水均为混合物 | |
| C. | “静电除尘”、“燃煤固硫”、“汽车尾气催化净化”都能提高空气质量 | |
| D. | 包装食品里常有硅胶、石灰、还原铁粉三类小包,其作用相同 |
| A. | 玻璃、水泥 | B. | 液晶材料、纳米材料 | ||
| C. | 塑料、橡胶 | D. | 半导体材料、绝缘体材料 |
| A. | 0.4 mol/L | B. | 0.3 mol/L | C. | 0.2 mol/L | D. | 0.1 mol/L |
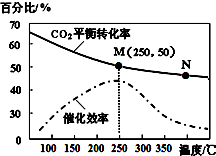 一定条件下合成乙烯:6H2(g)+2CO2(g)$\stackrel{催化剂}{?}$CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是( )
一定条件下合成乙烯:6H2(g)+2CO2(g)$\stackrel{催化剂}{?}$CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是( )| A. | 该反应的逆反应为吸热反应 | |
| B. | 平衡常数:KM>KN | |
| C. | 生成乙烯的速率:v(N)一定大于v(M) | |
| D. | 当温度高于250℃,升高温度,催化剂的催化效率降低 |
| A. | 6、7之间 | B. | 7、8之间 | C. | 8 | D. | 7 |
| A. | 明矾是常用的净水剂、具有杀菌、消毒的作用 | |
| B. | BaSO4在医学上用作钡餐,Ba2+对人体无毒 | |
| C. | 考古时,利用14C测定一些文物的年代 | |
| D. | 煤的干馏和石油的分馏都是化学变化 |