题目内容
5.酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是有碳粉,二氧化锰,氯化锌和氯化铵等组成的填充物,该电池在放电过程产生MnOOH.该电池的正极反应式为MnO2+e-+H+=MnOOH,负极反应式为Zn-2e-=Zn2+,电池反应的离子方程式为:Zn+2MnO2+2H+=Zn2++2MnOOH.分析 该原电池中,Zn易失电子作负极、二氧化锰作正极,正极上二氧化锰得电子发生还原反应,负极上锌失电子发生氧化反应,在得失电子相同条件下正负极电极反应式相加即得电池反应式.
解答 解:该原电池中,Zn易失电子作负极、二氧化锰作正极,正极上二氧化锰得电子发生还原反应,电极反应式为MnO2+e-+H+=MnOOH;负极上锌失电子发生氧化反应,电极反应式为Zn-2e-=Zn2+;在得失电子相同条件下正负极电极反应式相加即得电池反应式,电极反应式为 Zn+2MnO2+2H+=Zn2++2MnOOH;
故答案为:MnO2+e-+H+=MnOOH;Zn-2e-=Zn2+; Zn+2MnO2+2H+=Zn2++2MnOOH.
点评 本题考查电极反应式的书写,为高频考点,明确各个电极上发生的反应是解本题关键,电极反应式的书写也是学习难点,题目难度中等.

练习册系列答案
相关题目
15.下列说法中正确的是( )
| A. | 将硫酸钡放入水中不能导电,所以硫酸钡是非电解质 | |
| B. | SO3的水溶液能导电,所以SO3是电解质 | |
| C. | 乙醇在水溶液和熔融状态下均不能导电,所以乙醇属于非电解质 | |
| D. | 强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 |
20.下列反应的离子方程式书写正确的是( )
| A. | 石灰乳与稀盐酸反应:OH-+H+═H2O | |
| B. | 用稀硫酸除去铜绿:4H++Cu2(OH)2CO3═2Cu2++CO2↑+3H2O | |
| C. | NaHCO3溶液中滴加过量的Ba(OH)2溶液:2HCO3-+2OH-+Ba2+═BaCO3↓+CO32-+2H2O | |
| D. | 等体积、等浓度的Ca(HCO3)2溶液与NaOH溶液反应Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- |
10.五种短周期元素的某些性质如下表所示(其中只有W、Y、Z为同周期元素)
下列说法不正确的是( )
| 元素代号 | X | W | Y | Z | Q |
| 原子半径(×10-12m) | 37 | 64 | 66 | 70 | 154 |
| 主要化合价 | +1 | -1 | -2 | +5、-3 | +1 |
| A. | 由Q与Y形成的化合物中可能存在共价键 | |
| B. | Z与X之间形成的化合物具有还原性 | |
| C. | 由X、Y、Z三种元素形成的化合物,其晶体可能是离子晶体 | |
| D. | Y与W形成的化合物中,Y显负价 |
2.蛇纹石矿可以看做是由MgO、Fe2O3、Al2O3、SiO2组成.由蛇纹石制取碱式碳酸镁的实验步骤如下:
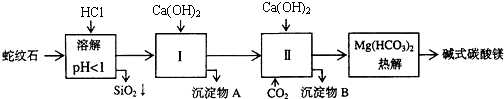
(1)蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是Fe3+、Al3+
(2)进行Ⅰ操作时,控制溶液pH=7-8(有关氢氧化物沉淀的pH见上表)Ca(OH)2不能过量,若Ca(OH)2过量可能会导致Al(OH)3溶解、Mg(OH)2沉淀生成.
(3)从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入NaOH(填入物质的化学式),然后过滤、洗涤、灼烧 (依次填写实验操作名称).
(4)物质循环使用,能节约资源.上述实验中,可以循环使用的物质是CaCO3或CO2(填写物质化学式).
(5)若热分解不完全,所得碱式碳酸镁中将混有MgCO3,则产品中镁的质量分数升高(填“升高”、“降低”或“不变”,已知碳酸镁的相对分子质量为84,碱式碳酸镁的相对分子质量大于84).

| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
(2)进行Ⅰ操作时,控制溶液pH=7-8(有关氢氧化物沉淀的pH见上表)Ca(OH)2不能过量,若Ca(OH)2过量可能会导致Al(OH)3溶解、Mg(OH)2沉淀生成.
(3)从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入NaOH(填入物质的化学式),然后过滤、洗涤、灼烧 (依次填写实验操作名称).
(4)物质循环使用,能节约资源.上述实验中,可以循环使用的物质是CaCO3或CO2(填写物质化学式).
(5)若热分解不完全,所得碱式碳酸镁中将混有MgCO3,则产品中镁的质量分数升高(填“升高”、“降低”或“不变”,已知碳酸镁的相对分子质量为84,碱式碳酸镁的相对分子质量大于84).
3.下列有关物质的性质与应用相对应的是( )
| A. | 二氧化锰具有强氧化性,可用作H2O2分解的氧化剂 | |
| B. | 浓硝酸在常温下能使铝钝化,可用铝槽车运输浓硝酸 | |
| C. | K2FeO4具有还原性,可用于自来水的杀菌消毒 | |
| D. | SO2具有漂白性,能使紫色KMnO4溶液褪色 |