题目内容
18.300mL Al2(SO4)3溶液中,含Al 3+为1.62g,在该溶液中加入0.1mol/L Ba(OH)2溶液300mL,反应后溶液中SO42-的物质的量浓度为( )| A. | 0.4 mol/L | B. | 0.3 mol/L | C. | 0.2 mol/L | D. | 0.1 mol/L |
分析 硫酸铝溶液中c(Al 3+)=$\frac{\frac{1.62g}{27g/mol}}{0.3L}$=0.2mol/L,根据化学式知c(SO42-)=$\frac{3}{2}$c(Al 3+)=$\frac{3}{2}$×0.2mol/L=0.3mol/L,n(SO42-)=0.3mol/L×0.3L=0.09mol;向该溶液中加入氢氧化钡,二者反应生成硫酸钡和水,n[Ba(OH)2]=0.1mol/L×0.3L=0.03mol,0.03mol钡离子完全反应需要0.03mol硫酸根离子,则混合溶液中剩余n(SO42-)=0.09mol-0.03mol=0.06mol,根据C=$\frac{n}{V}$计算混合溶液中硫酸根离子物质的量浓度.
解答 解:硫酸铝溶液中c(Al 3+)=$\frac{\frac{1.62g}{27g/mol}}{0.3L}$=0.2mol/L,根据化学式知c(SO42-)=$\frac{3}{2}$c(Al 3+)=$\frac{3}{2}$×0.2mol/L=0.3mol/L,n(SO42-)=0.3mol/L×0.3L=0.09mol;向该溶液中加入氢氧化钡,二者反应生成硫酸钡和水,n[Ba(OH)2]=0.1mol/L×0.3L=0.03mol,0.03mol钡离子完全反应需要0.03mol硫酸根离子,则混合溶液中剩余n(SO42-)=0.09mol-0.03mol=0.06mol,混合溶液中硫酸根离子物质的量浓度C=$\frac{n}{V}$=$\frac{0.06mol}{0.3L+0.3L}$=0.1 mol/L,
故选D.
点评 本题考查物质的量浓度有关计算,为高频考点,明确各个微粒之间关系及离子之间反应是解本题关键,题目难度不大.

| A. | 萃取、蒸馏、分液 | B. | 萃取、分液、蒸馏 | C. | 分液、蒸馏、萃取 | D. | 蒸馏、萃取、分液 |
| A. | 甲和乙一定是同分异构体 | |
| B. | 甲和乙不可能是同系物 | |
| C. | 甲和乙各1mol完全燃烧后,生成的二氧化碳的质量一定相等 | |
| D. | 甲和乙的分子中,碳、氢原子个数之比相同 |
| 组号 | 反应温度 (℃) | 参加反应的物质 | H2O体积(mL) | |||
| Na2S2O3 | H2SO4 | |||||
| 体积(mL) | 浓度(mol.L-1) | 体积(mL) | 浓度(mol.L-1) | |||
| A | 10 | 5 | 0.1 | 10 | 0.1 | 5 |
| B | 10 | 5 | 0.1 | 5 | 0.1 | 10 |
| C | 30 | 5 | 0.1 | 5 | 0.1 | 10 |
| D | 30 | 5 | 0.2 | 5 | 0.2 | 10 |
| A. | A | B. | B | C. | C | D. | D |
| 元素代号 | X | W | Y | Z | Q |
| 原子半径(×10-12m) | 37 | 64 | 66 | 70 | 154 |
| 主要化合价 | +1 | -1 | -2 | +5、-3 | +1 |
| A. | 由Q与Y形成的化合物中可能存在共价键 | |
| B. | Z与X之间形成的化合物具有还原性 | |
| C. | 由X、Y、Z三种元素形成的化合物,其晶体可能是离子晶体 | |
| D. | Y与W形成的化合物中,Y显负价 |
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
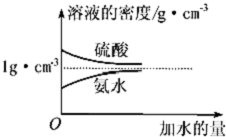 按要求完成下列填空:
按要求完成下列填空: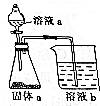 如图是中学化学常见的装置,可用该装置验证元素非金属性的强弱.
如图是中学化学常见的装置,可用该装置验证元素非金属性的强弱.