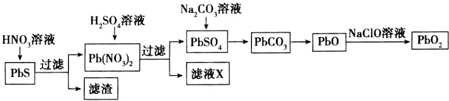
题目内容
11.下列离子方程式的书写正确的是( )| A. | 在硫酸铜溶液中加入过量氢氧化钡溶液 Ba2++SO42-=BaSO4↓ | |
| B. | 钠与水的反应Na+2H2O═Na++2OH-+H2↑ | |
| C. | 氯气通入氢氧化钠溶液中 2Cl2+2OH-=3Cl-+ClO-+H2O | |
| D. | 大理石溶于醋酸的反应CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O |
分析 A.漏写生成氢氧化铜的离子反应;
B.电子、电荷不守恒;
C.电子、电荷不守恒;
D.反应生成醋酸钙、水、二氧化碳.
解答 解:A.在硫酸铜溶液中加入过量氢氧化钡溶液的离子反应为Cu2++2OH-+Ba2++SO42-=BaSO4↓+Cu(OH)2↓,故A错误;
B.钠与水的反应的离子反应为2Na+2H2O═2Na++2OH-+H2↑,故B错误;
C.氯气通入氢氧化钠溶液中的离子反应为Cl2+2OH-=Cl-+ClO-+H2O,故C错误;
D.大理石溶于醋酸的反应的离子反应为CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O,故D正确;
故选D.
点评 本题考查离子反应的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的考查,题目难度不大.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
1.某同学设计原电池装置如图所示.下列说法正确的是( )


| A. | 电子由铁极经溶液向铂极迁移 | |
| B. | 放电过程中交换膜右侧溶液颜色逐渐变浅 | |
| C. | 正极的电极反应式为Fe3++3e-=Fe | |
| D. | 若转移2mole-,交换膜右侧溶液中约减少3 mol离子 |
2.只用一种试剂可区别硫酸钠,硫酸镁,氯化铝,氯化铵四种溶液,这种试剂是( )
| A. | 盐酸 | B. | 氢氧化钠 | C. | 氯化钡 | D. | 硝酸银 |
19.设NA为阿伏伽德罗常数,下列叙述正确的是( )
| A. | 0.5mol/L K2SO4溶液所含K+数目为NA | |
| B. | 标况下22.4L苯所含分子数目为NA | |
| C. | 56gFe与足量盐酸完全反应时,失去电子数目为NA | |
| D. | 常温常压下,16gO2和O3的混合气体所含原子数目为NA |
3.环境保护是现代的世界性课题,人类已在多方面取得了突破性进展.
(1)连续自动监测氮氧化物(NOx)的仪器--动态库仑仪已获得实际应用.它的工作原理如下图一所示.NiO电极上NO发生的电极反应式为NO+O2--2e-=NO2.
(2)使用稀土催化剂有效消除汽车尾气中的NOx、碳氢化合物也已逐渐成为成熟技术.压缩天然气汽车利用这一技术将NOx、CH4转化成无毒物质,相关反应为:
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1<0
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2<0
③CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H3
则△H3=△H1+△H22.(用△H1和△H2表示)
(3)实验室在恒压下,将CH4(g)和NO2(g)置于密闭容器中发生反应③,测得在不同温度、不同投料比时,NO2的平衡转化率如下表:
①在NO2与CH4反应时,可提高NO2转化率的措施有CEF.(填编号)
A.增加催化剂的表面积B.改用高效催化剂 C.降低温度
D.增大压强E.分离出H2O(g) F.减小[n(NO2)/n(CH4)]
②400K时,将投料比为1的NO2和CH4的混合气体共0.40mol,充入容积为2L的装有催化剂的密闭容器中,反应经过5min达到平衡,试计算反应在该温度时的平衡常数.(写出计算过程,计算结果保留三位有效数字)
③若温度不变,在反应进行到10min时将容器的容积快速压缩为1L,请在答题卷表格中画出0min~15min内,容器中CO2物质的量浓度c随时间变化的曲线图.
(4)SNCR是一种新型的烟气脱氮环保技术.在有氧条件下,其脱氮原理是:NO(g)+4NH3(g)+O2(g)═4N2(g)+6H2O(g)△H=-1627.2kJ•mol-1.NO和NH3在Ag2O催化剂表面的反应随温度的变化曲线如右图所示.图中曲线表明,随着反应温度的升高,在有氧的条件下NO的转化率有一明显的下降过程,其原因可能是(回答两条):脱氮反应是放热反应,达到平衡后升高温度,平衡逆向移动;温度升高发生了副反应:4NH3+5O2═4NO+6H2O.
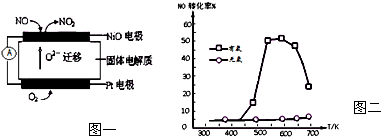
(1)连续自动监测氮氧化物(NOx)的仪器--动态库仑仪已获得实际应用.它的工作原理如下图一所示.NiO电极上NO发生的电极反应式为NO+O2--2e-=NO2.
(2)使用稀土催化剂有效消除汽车尾气中的NOx、碳氢化合物也已逐渐成为成熟技术.压缩天然气汽车利用这一技术将NOx、CH4转化成无毒物质,相关反应为:
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1<0
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2<0
③CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H3
则△H3=△H1+△H22.(用△H1和△H2表示)
(3)实验室在恒压下,将CH4(g)和NO2(g)置于密闭容器中发生反应③,测得在不同温度、不同投料比时,NO2的平衡转化率如下表:
| 投料比[n(NO2)/n(CH4)] | 400K | 500K | 600K |
| 1 | 60% | 43% | 28% |
| 2 | 45% | 33% | 20% |
A.增加催化剂的表面积B.改用高效催化剂 C.降低温度
D.增大压强E.分离出H2O(g) F.减小[n(NO2)/n(CH4)]
②400K时,将投料比为1的NO2和CH4的混合气体共0.40mol,充入容积为2L的装有催化剂的密闭容器中,反应经过5min达到平衡,试计算反应在该温度时的平衡常数.(写出计算过程,计算结果保留三位有效数字)
③若温度不变,在反应进行到10min时将容器的容积快速压缩为1L,请在答题卷表格中画出0min~15min内,容器中CO2物质的量浓度c随时间变化的曲线图.
(4)SNCR是一种新型的烟气脱氮环保技术.在有氧条件下,其脱氮原理是:NO(g)+4NH3(g)+O2(g)═4N2(g)+6H2O(g)△H=-1627.2kJ•mol-1.NO和NH3在Ag2O催化剂表面的反应随温度的变化曲线如右图所示.图中曲线表明,随着反应温度的升高,在有氧的条件下NO的转化率有一明显的下降过程,其原因可能是(回答两条):脱氮反应是放热反应,达到平衡后升高温度,平衡逆向移动;温度升高发生了副反应:4NH3+5O2═4NO+6H2O.

1.在新制的CO2中常混有O2、H2S、HCl和水蒸气等四种杂质,可使用(1)浓H2SO4(2)红热的铜丝(3)饱和的碳酸氢钠溶液(4)CuSO4 溶液.逐一除去杂质得到干燥、纯净的CO2,其正确的操作顺序是( )
| A. | (1)(3)(4) | B. | (2)(3)(4)(1) | C. | (4)(1)(3)(2) | D. | (3)(4)(1)(2) |