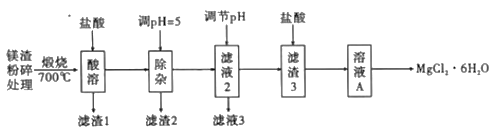
题目内容
【题目】已知25°C时有关弱酸的电离平衡常数如下表:
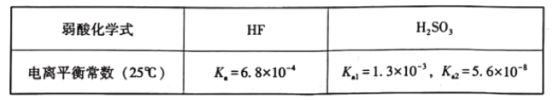
下列有关说法正确的是( )
A.等物质的量浓度的各溶液pH关系:pH(Na2SO3)<pH(NaF)<pH(NaHSO3)
B.将0.lmo/L的HF与0.1mol/L的NaF等体积混合,混合液pH>7
C.Na2SO3溶液中加入足量HF发生反应的离子方程式为SO32-+HF=F-+HSO3-
D.NaHSO3溶液中部分微粒浓度的大小:c(Na+)>c(HSO3-)>c(H2SO3)>c(SO32-)
【答案】C
【解析】
A.电离平衡常数越大,酸的酸性越强,其对应的酸根离子水解程度越小,则相同浓度的钠盐溶液的pH越小,电离平衡常数H2SO3>HF>HSO3-,则水解程度:SO32->F->HSO3-,所以相同浓度的钠盐:pH(Na2SO3)>pH(NaF)>pH(NaHSO3),故A错误;
B.HF的Ka=6.8×10-6,其水解平衡常数Kh=![]() ≈1.47×10-9<6.8×10-6,说明HF电离程度大于F-水解程度,则将等浓度的HF溶液与NaF溶液等体积混合,混合液中呈酸性,故B错误;
≈1.47×10-9<6.8×10-6,说明HF电离程度大于F-水解程度,则将等浓度的HF溶液与NaF溶液等体积混合,混合液中呈酸性,故B错误;
C.电离平衡常数H2SO3>HF>HSO3-,Na2SO3溶液中加入足量HF发生反应的离子方程式为SO32-+HF=F-+HSO3-,故C正确;
D.H2SO3的Ka2=5.6×10-8,则SO32-的Kh2=![]() ≈7.7×10-12<Ka2,则HSO3-的电离程度大于水解程度,所以NaHSO3溶液中部分微粒浓度的大小为:c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3),故D错误;
≈7.7×10-12<Ka2,则HSO3-的电离程度大于水解程度,所以NaHSO3溶液中部分微粒浓度的大小为:c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3),故D错误;
故选C。

【题目】实验室需配制480mL 0.1 mol/L的Na2CO3溶液,填空并回答下列问题:
(1)配制480mL 0.1 mol/L的Na2CO3溶液。
实际应称Na2CO3质量/g | 应选用容量瓶的规格/mL |
____________ | ____________ |
(2)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)____________。
A.用30 mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.将准确称量的Na2CO3固体倒入烧杯中,再加适量水溶解
C.将已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1 cm~2 cm处
(3)若出现如下情况,对所配溶液浓度将有何影响?(填“偏高”“偏低”或“无影响”)
转移溶液后,未洗涤烧杯和玻璃棒就直接定容________;若定容时俯视刻度线__________。
(4)若实验过程中出现如下情况如何处理?
加蒸馏水时不慎超过了刻度_______________