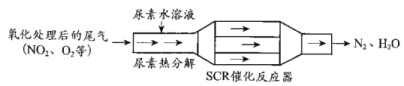
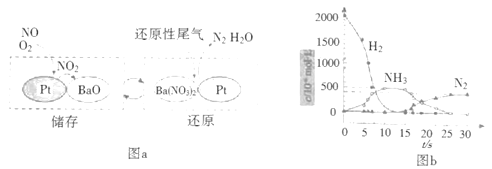
题目内容
【题目】电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示。根据该表,回答下列问题:
化学式 | HF | CH3COOH | H2SO3 | H2CO3 | H2S |
电离平衡 常数(Ka) | 4.0×10-4 | 1.8×10-5 | K1=1.54×10-2 K2=1.02×10-7 | K1=4.4×10-7 K2=4.7×10-11 | K1=9.1×10-8 K2=1.1×10-12 |
(1)同浓度的F-、CO32-、CH3COO-、HS-结合H+的能力最强的为__________
(2)溶液中不可能大量共存的离子组是__________
a.HS-、SO32- b.HF、CH3COO- c.HS-、HCO3- d. HSO3-、HCO3-
(3)Na2CO3溶液通入过量H2S的离子方程式是:_____。
(4)OH-浓度相同的等体积的两份溶液HCl(A)和 CH3COOH(E),分别与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是_______(填写序号)。
①反应所需要的时间E>A ②开始反应时的速率A>E
③参加反应的锌的物质的量A=E ④反应过程的平均速率E>A
⑤A溶液里有锌剩余 ⑥E溶液里有锌剩余
(5)向 0.l molL-1 CH3COOH溶液中滴加 NaOH 溶液至c(CH3COOH) : c(CH3COO-) =2 : 36,此时溶液pH = __________。
【答案】CO32- b H2S+CO32- =HCO3-+HS- ③④⑤ 6
【解析】
(1) 酸根对应的酸越弱结合H+能力越强,根据电离平衡常数,酸的酸性强弱为:HF>CH3COOH>H2S>HCO3,所以对应的碱结合H+的能力强弱为:CO32>HS>CH3COO>F,则其中结合H+能力最强的是CO32,
故答案为:CO32;
(2) a.酸性强弱为HSO3>HS,所以HS与SO32反应进行的程度不大,可以共存,故a不选;
b.酸性强弱为HF>CH3COOH,则HF可以与CH3COO反应,不可以共存,故b选;
c.HS和HCO3均为水解程度大于电离程度,所在溶液均为碱性,可以共存,故c不选;
d.酸性强弱H2CO3>HSO3,所以HSO3与HCO3可以共存,故d不选,
故答案为:b;
(3) Na2CO3溶液通入过量H2S,酸性强弱为H2CO3>H2S>HCO3>HS,反应生成HCO3,H2S转化为HS,则反应的离子方程式为:H2S+CO32- =HCO3-+HS-,
故答案为:H2S+CO32- =HCO3-+HS-;
(4) ①反应所需要的时间与反应速率成反比,反应速率与氢离子浓度成正比,反应过程中醋酸继续电离出氢离子,导致氢离子浓度A< E,反应速率A< E,则反应所需时间A> E,故①错误;
②反应速率与氢离子浓度成正比,开始时A.B氢离子浓度相等,反应速率A= E,故②错误;
③生成的氢气相同,根据转移电子守恒知,消耗的锌A= E,故③正确;
④氢离子浓度越大,反应速率越大,反应过程中氢离子浓度A< E,反应过程的平均速率E >A
,故④正确;
⑤酸最终电离出氢离子物质的量越少的,锌可能有剩余,两种酸中酸最终电离出的氢离子浓度A< E,则可能A剩余锌,故⑤正确,⑥错误;
答案为:③④⑤;
(5) 向0.1mol/L的CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=2:36,则溶液中c(H+)=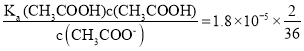 =106mol/L,则溶液pH=lgc(H+)=6;
=106mol/L,则溶液pH=lgc(H+)=6;
答案为:6;

 天天练口算系列答案
天天练口算系列答案【题目】已知某气体反应的平衡常数可表示为K=![]() ,该反应在不同温度下的平衡常数:400℃,K=32;500℃,K=44。请回答下列问题:
,该反应在不同温度下的平衡常数:400℃,K=32;500℃,K=44。请回答下列问题:
(1)写出上述反应的化学方程式____。
(2)已知在密闭容器中,测得某时刻各组分的浓度如下:
物质 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
浓度/(molL-1) | 0.54 | 0.68 | 0.68 |
①此时温度400℃,则某时刻υ正____υ逆(填<、>或=,下同)。
②若以温度为横坐标,以该温度下平衡态甲醇物质的量n为纵坐标,此时反应点在图象的位置是图中___点,比较图中B、D两点所对应的正反应速率υB_____υD,理由是____。

(3)一定条件下要提高反应物的转化率,可以采用的措施是___。
a.升高温度 b.加入催化剂 c.压缩容器的体积 d.增加水蒸气的浓度 e.及时分离出产物
【题目】化学在生产和日常生活中有着重要的应用,下表中用途与其性质或原理对应关系不正确的是 ( )
选项 | 现象或事实 | 解释 |
A | Na2O2常用于潜水艇或呼吸面具的供氧剂 | Na2O2与H2O、CO2反应产生O2 |
B | 常用铝箔做包装材料 | 金属铝有好的延展性 |
C | FeCl3溶液可用于刻制印刷铜电路板 | FeCl3可与Cu发生反应 |
D | 烧菜用过的铁锅,经放置常出现红棕色斑迹 | 烧菜时铁锅被染色 |
A.AB.BC.CD.D